- 1 Thông tư 01/2013/TT-BYT hướng dẫn thực hiện quản lý chất lượng xét nghiệm tại cơ sở khám, chữa bệnh do Bộ trưởng Bộ Y tế ban hành
- 2 Thông tư liên tịch 58/2015/TTLT-BYT-BTNMT quy định về quản lý chất thải y tế do Bộ trưởng Bộ Y tế - Bộ Tài nguyên và Môi trường ban hành
- 3 Quyết định 2429/QĐ-BYT năm 2017 Tiêu chí đánh giá mức chất lượng phòng xét nghiệm y học do Bộ trưởng Bộ Y tế ban hành
- 4 Quyết định 3310/QĐ-BYT năm 2019 hướng dẫn chẩn đoán, điều trị bệnh viêm gan vi rút B do Bộ trưởng Bộ Y tế ban hành
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 1868/QĐ-BYT | Hà Nội, ngày 24 tháng 4 năm 2020 |
VỀ VIỆC BAN HÀNH HƯỚNG DẪN XÉT NGHIỆM VI RÚT VIÊM GAN B, C
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức Bộ Y tế;
Xét biên bản họp ngày 24/10/2019 của Hội đồng chuyên môn nghiệm thu hướng dẫn xét nghiệm vi rút viêm gan B, C;
Xét đề nghị của Cục trưởng Cục Quản lý Khám, chữa bệnh - Bộ Y tế,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này Hướng dẫn xét nghiệm vi rút viêm gan B, C và các phụ lục kèm theo.
Điều 2. Hướng dẫn xét nghiệm vi rút viêm gan B, C áp dụng cho tất cả các cơ sở khám, chữa bệnh Nhà nước và tư nhân trên cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 4. Các ông, bà: Cục trưởng Cục Quản lý Khám, chữa bệnh; Chánh Văn phòng Bộ; Chánh Thanh tra Bộ; các Vụ trưởng, Cục trưởng của Bộ Y tế; Giám đốc các bệnh viện, viện có giường bệnh trực thuộc Bộ Y tế; Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; Thủ trưởng y tế các Bộ, ngành; Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này./.
|
| KT. BỘ TRƯỞNG |
XÉT NGHIỆM VI RÚT VIÊM GAN B, C
(Ban hành theo quyết định 1868/QĐ-BYT ngày 24 tháng 04 năm 2020 của Bộ trưởng Bộ Y tế)
1.1. Xét nghiệm vi rút viêm gan B, C trong chẩn đoán, theo dõi, điều trị và phòng ngừa lây nhiễm vi rút viêm gan B, C.
1.2. Thực hiện bảo đảm chất lượng xét nghiệm vi rút viêm gan B, C.
1.3. Tổ chức thực hiện.
2.1. Phát hiện, chẩn đoán, theo dõi điều trị và phòng ngừa lây nhiễm vi rút viêm gan B, C.
2.2. Đảm bảo an toàn trong truyền máu, cấy ghép mô/tạng, thụ tinh nhân tạo.
2.3. Giám sát dịch tễ nhiễm vi rút viêm gan B và C và nghiên cứu khoa học.
3.1. Đảm bảo tính bảo mật và tự nguyện.
3.2. Cung cấp thông tin trước xét nghiệm và tư vấn sau xét nghiệm.
3.3. Tuân thủ phương cách, quy trình xét nghiệm.
3.4. Đảm bảo chất lượng xét nghiệm.
3.5. Kết nối với các chương trình dự phòng, chăm sóc và điều trị.
4. Phương pháp và kỹ thuật xét nghiệm
Các xét nghiệm chẩn đoán vi rút viêm gan B và C được chia thành hai nhóm kỹ thuật xét nghiệm.
4.1. Xét nghiệm huyết thanh học
Là xét nghiệm phát hiện các kháng nguyên và kháng thể đặc hiệu của hai vi rút viêm gan B, C bằng các kỹ thuật xét nghiệm dựa trên nguyên lý miễn dịch. Theo mức độ đơn giản của kỹ thuật xét nghiệm, điều kiện cơ sở vật chất cần thiết, xét nghiệm huyết thanh chia thành 2 dạng.
4.1.1. Xét nghiệm nhanh (Rapid Diagnostic Test - RDT): Cách thực hiện đơn giản, cho kết quả nhanh.
4.1.2. Xét nghiệm tại phòng xét nghiệm (Laboratory-based assays), sử dụng các kỹ thuật theo nguyên lý miễn dịch đánh dấu, ví dụ:
- Miễn dịch gắn men (Enzyme Linked Immunoarobent Assays - ELISA).
- Miễn dịch hoá phát quang (Chemoluminescence Immunoassay - CLIA).
- Miễn dịch điện hoá phát quang (Electrochemoluminescence Immunoassay - ECLIA).
- Miễn dịch vi hạt gắn men (Microparticle enzyme Immunoassays - MEIA).
- Miễn dịch vi hạt hoá phát quang (Chemiluminesence microparticle Immunoassays-CMIA).
Các xét nghiệm huyết thanh học chủ yếu được thực hiện trên mẫu huyết thanh, huyết tương. Xét nghiệm nhanh có thể thực hiện trên cả mẫu máu toàn phần, dịch miệng.
4.2. Xét nghiệm sinh học phân tử
- Định tính: phát hiện HBV DNA, HCV RNA bằng kỹ thuật tổng hợp chuỗi (Polymerase Chain Reaction - PCR) khuyếch đại vật liệu di truyền của HBV, HCV.
- Định lượng (tải lượng) HBV, HCV: xác định mật độ vi rút trong máu bằng kỹ thuật tổng hợp chuỗi định lượng (Real-time PCR) vật liệu di truyền của HBV, HCV. Đây là xét nghiệm cần cho chỉ định điều trị và theo dõi điều trị viêm gan vi rút mạn bằng các thuốc kháng vi rút.
- Kiểu gien HBV, HCV: chỉ thực hiện khi phải lựa chọn phác đồ điều trị phù hợp với kiểu gien của vi rút (đối với bệnh nhân viêm gan C) hoặc khi người bệnh được chẩn đoán thất bại điều trị nghi ngờ do kháng thuốc.
- Theo mức độ đơn giản của kỹ thuật xét nghiệm, điều kiện cơ sở vật chất cần thiết, xét nghiệm sinh học phân tử, chia thành 2 dạng:
Xét nghiệm tại điểm chăm sóc (Point of Care Test): sử dụng các thiết bị đơn giản có khả năng thực hiện tại các tuyến y tế cơ sở và cho kết quả nhanh.
Xét nghiệm tại phòng xét nghiệm (Laboratory - based assays) trên các hệ thống tự động (automatic), bán tự động (semi-automatic) hoặc thao tác thủ công.
HƯỚNG DẪN XÉT NGHIỆM VI RÚT VIÊM GAN B TRONG CHẨN ĐOÁN VÀ TRỊ
1.1. Người sinh trước năm 2003 - năm triển khai chương trình vắc xin viêm gan B cho trẻ dưới một tuổi trên toàn quốc.
1.2. Người đến tư vấn, xét nghiệm tại các phòng khám tư vấn xét nghiệm HIV, lao.
1.3. Phụ nữ mang thai.
1.4. Người có hành vi nguy cơ lây nhiễm HBV: người nhiễm HIV, người tiêm chích ma tuý, nam quan hệ tình dục đồng giới, phụ nữ mại dâm, phạm nhân, người có quan hệ tình dục không an toàn.
1.5. Người có biểu hiện nghi ngờ mắc viêm gan: có triệu chứng lâm sàng của viêm gan và hoặc xét nghiệm men gan tăng.
1.6. Người bệnh phải lọc máu, truyền máu và chế phẩm máu.
1.7. Người bệnh trước khi trị ức chế miễn dịch, hoá trị liệu.
1.8. Nhân viên y tế chưa được tiêm vắc xin viêm gan B.
1.9. Người hiến máu, người hiến tạng, người cho trứng, tinh trùng.
1.10. Bạn tình, con cái, thành viên gia đình có tiếp xúc gần gũi với người nhiễm HBV.
1.11. Người có tiền sử tiêm, làm thủ thuật không an toàn.
1.12. Các đối tượng khác theo yêu cầu.
2.1. Các xét nghiệm vi rút viêm gan B.
Bảng 1: Các xét nghiệm vi rút viêm gan B
| Xét nghiệm | Mục đích xét nghiệm | Kỹ thuật xét nghiệm |
| HBsAg | Xét nghiệm định tính để chẩn đoán nhiễm HBV | - Xét nghiệm nhanh (RDTs) - Miễn dịch đánh dấu |
| Xét nghiệm định lượng HBsAg để theo dõi điều trị | - Miễn dịch đánh dấu | |
| anti-HBs | Xét nghiệm định tính xác định sự xuất hiện kháng thể trung hoà anti-HBs | - Test nhanh (RDTs) - Miễn dịch đánh dấu |
| Xét nghiệm định lượng xác định mức kháng thể trung hoà anti-HBs, đánh giá được mức miễn dịch bảo vệ | Miễn dịch đánh dấu | |
| anti-HBc total | Xác định phơi nhiễm HBV | - Test nhanh (RDTs) - Miễn dịch đánh dấu |
| anti-HBc IgG | Xác định phơi nhiễm HBV | Miễn dịch đánh dấu |
| anti-HBc IgM | Xác định nhiễm HBV cấp | Miễn dịch đánh dấu |
| HBeAg | - Xác định khả năng lây truyền vi rút ở người nhiễm HBV - Xác định giai đoạn bệnh trong quản lý lâm sàng | - Test nhanh (RDTs) - Miễn dịch đánh dấu |
| anti-HBe | - Xác định sự chuyển đảo huyết thanh HBeAg - Xác định giai đoạn bệnh trong quản lý lâm sàng | - Test nhanh (RDTs) - Miễn dịch đánh dấu |
| Định tính HBV DNA | Khẳng định có HBV lưu hành trong máu | Nucleic axit testing (NAT), định tính |
| Tải lượng HBV | Xác định mật độ HBV lưu hành trong máu | Nucleic axit testing (NAT), định lượng |
| Kiểu gien HBV | Xác định kiểu gien HBV, đột biến kháng thuốc | Giải trình tự, các kỹ thuật sinh học phân tử khác |
2.2. Chiến lược xét nghiệm và chẩn đoán nhiễm HBV
2.2.1. Xét nghiệm HBsAg
- Xét nghiệm nhiễm HBV được thực hiện bằng xét nghiệm phát hiện kháng nguyên HBsAg.
- Sử dụng kỹ thuật xét nghiệm miễn dịch như xét nghiệm nhanh (RDTs), xét nghiệm miễn dịch đánh dấu (EIAs, CLIAs, ECLs...).
- Khi phải khẳng định lại kết quả xét nghiệm HBsAg, cần áp dụng kỹ thuật khẳng định (HBsAg confirmation).
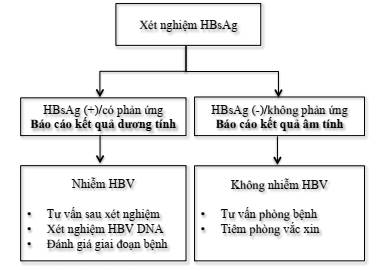
Hình 1: Chiến lược xét nghiệm HBV
* Phiên giải kết quả và tư vấn sau xét nghiệm HBsAg
- Người có kết quả xét nghiệm HBsAg ( ):
Nhiễm HBV
Người bệnh cần được xét nghiệm các dấu ấn khác của HBV, tải lượng HBV và các xét nghiệm hóa sinh, huyết học để xác định nhiễm HBV cấp hay mạn, đánh giá tiêu chuẩn điều trị và theo dõi tiến triển.
Người bệnh cần được tư vấn về chế độ ăn uống, sinh hoạt để ngăn ngừa tổn thương gan cũng như các biện pháp giảm nguy cơ lây truyền HBV.
- Người có kết quả xét nghiệm HBsAg (-): Không có bằng chứng hiện nhiễm HBV.
2.2.2. Xét nghiệm anti-HBs để xác định tình trạng miễn dịch bảo vệ với HBV
2.2.3. Xét nghiệm huyết thanh học phát hiện các dấu ấn vi rút viêm gan B khác
- Người có xét nghiệm HBsAg dương tính cần được làm xét nghiệm huyết thanh học để phát hiện các dấu ấn viêm gan B khác (Hình 2. Sơ đồ xét nghiệm chẩn đoán nhiễm vi rút viêm gan B).
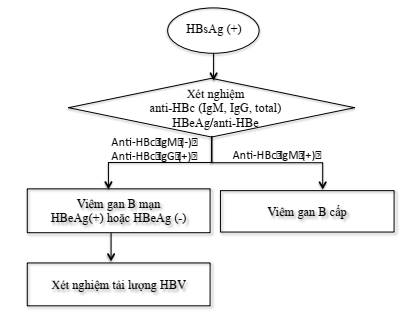
Hình 2: Sơ đồ xét nghiệm chẩn đoán nhiễm vi rút viêm gan B
2.2.4. Xét nghiệm tải lượng HBV
- Xét nghiệm tải lượng HBV nên thực hiện cho tất cả các trường hợp có HBsAg dương tính để đánh giá tiêu chuẩn điều trị (Hướng dẫn chẩn đoán, điều trị bệnh viêm gan vi rút B ban hành theo quyết định số 3310/QĐ-BYT ngày 29 tháng 7 năm 2019 của Bộ trưởng Bộ Y tế).
- Kết quả xét nghiệm tải lượng HBV cần được báo cáo hoặc quy đổi theo đơn vị quốc tế IU/ml.
2.2.5. Tổng hợp phiên giải kết quả xét nghiệm dấu ấn HBV
Tình trạng nhiễm HBV được xác định dựa trên phân tích tổng hợp kết quả xét nghiệm dấu ấn HBV (Bảng 2).
Bảng 2: Phiên giải kết quả xét nghiệm vi rút viêm gan B
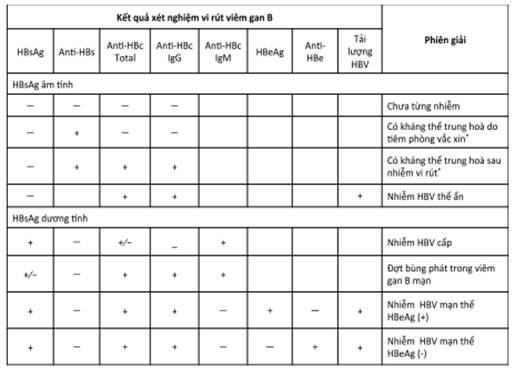
* Kháng thể trung hoà anti-HBs sau tiêm vắc xin hoặc sau nhiễm HBV trên 10 IU/ml là có miễn dịch bảo vệ.
2.3. Xét nghiệm huyết thanh học HBV và tải lượng HBV trong theo dõi điều trị
2.3.1. Người bệnh viêm gan vi rút B mạn chưa điều trị
Xét nghiệm HBeAg, anti-HBe định kỳ 24-48 tuần. Xem xét thực hiện xét nghiệm tải lượng HBV định kỳ 24-48 tuần.
2.3.2. Người bệnh viêm gan vi rút B mạn đang điều trị
- Khi bệnh ổn định (không có triệu chứng lâm sàng, xét nghiệm AST và ALT < 2 lần giới hạn trên của khoảng sinh học tham chiếu (ULN) và có đáp ứng vi rút ban đầu): làm các xét nghiệm HBeAg (nếu HBeAg dương tính) hoặc anti-HBe (nếu HBeAg âm tính) tại mỗi lần tái khám định kỳ.
- Xét nghiệm tải lượng HBV ở tuần điều trị thứ 12, 24 và 48. Sau đó thực hiện định kỳ 24-48 tuần một lần hoặc khi ALT tăng không rõ nguyên nhân để đánh giá đáp ứng điều trị và khả năng tái hoạt hoặc khi người bệnh không tuân thủ điều trị.
- Xét nghiệm tải lượng HBV theo dõi điều trị nên được thực hiện trên cùng một hệ thống xét nghiệm.
2.3.3. Người bệnh viêm gan vi rút B mạn đã ngừng điều trị
Trong năm đầu sau khi ngừng thuốc, xét nghiệm tải lượng HBV định kỳ 12 tuần một lần. Sau đó định kỳ 24-48 tuần một lần.
2.4. Xét nghiệm phân tích đột biến kháng thuốc
Nên thực hiện xét nghiệm kiểu gien HBV, phân tích đột biến kháng thuốc cho các trường hợp thất bại điều trị để phát hiện và khẳng định tình trạng kháng thuốc.
HƯỚNG DẪN XÉT NGHIỆM VI RÚT VIÊM GAN C TRONG CHẨN ĐOÁN VÀ TRỊ
1. Đối tượng xét nghiệm vi rút viêm gan C
1.1. Người có nguy cơ cao nhiễm HCV: người nhiễm HIV, người tiêm chích ma tuý, nam quan hệ tình dục đồng giới, phụ nữ mại dâm, phạm nhân, người có hành vi quan hệ tình dục không an toàn.
1.2. Người có biểu hiện nghi ngờ mắc viêm gan: có triệu chứng lâm sàng của viêm gan và hoặc xét nghiệm có men gan tăng.
1.3. Người bệnh phải lọc máu, truyền máu và chế phẩm máu.
1.4. Người bệnh trước khi trị ức chế miễn dịch, hoá trị liệu.
1.5. Người hiến máu, người hiến tạng, người cho trứng, tinh trùng.
1.6. Bạn tình, con cái, thành viên gia đình có tiếp xúc gần gũi với người nhiễm HCV.
1.7. Người có tiền sử tiêm, làm thủ thuật không an toàn.
1.8. Các đối tượng khác theo yêu cầu.
2.1. Các loại xét nghiệm chẩn đoán nhiễm vi rút viêm gan C
2.1.1. Xét nghiệm phát hiện anti-HCV: là xét nghiệm ban đầu để xác định tình trạng phơi nhiễm HCV. Người bệnh có kết quả dương tính chứng tỏ đã có phơi nhiễm HCV, cần thực hiện tiếp các xét nghiệm chẩn đoán để xác định tình trạng hiện nhiễm HCV.
2.1.2. Xét nghiệm chẩn đoán: các xét nghiệm chẩn đoán dựa vào việc phát hiện kháng nguyên hoặc RNA của HCV trong máu.
2.2. Chiến lược xét nghiệm và chẩn đoán
2.2.1. Xét nghiệm phát hiện anti-HCV
- Xét nghiệm kháng thể anti-HCV sử dụng loại xét nghiệm miễn dịch bằng xét nghiệm nhanh (RDTs) hoặc xét nghiệm miễn dịch tại phòng xét nghiệm (ELISA, CLIA, ECLIA…).
- Khi phải khẳng định lại kết quả xét nghiệm anti-HCV, cần áp dụng kỹ thuật khẳng định (anti-HCV confirmation).
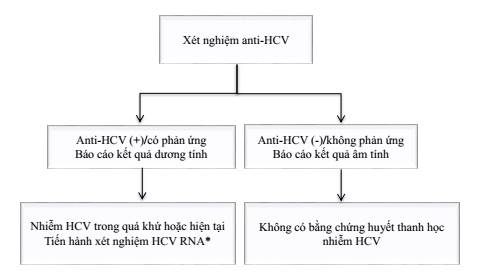
* Khi không thực hiện được xét nghiệm HCV RNA có thể làm xét nghiệm HCVcAg
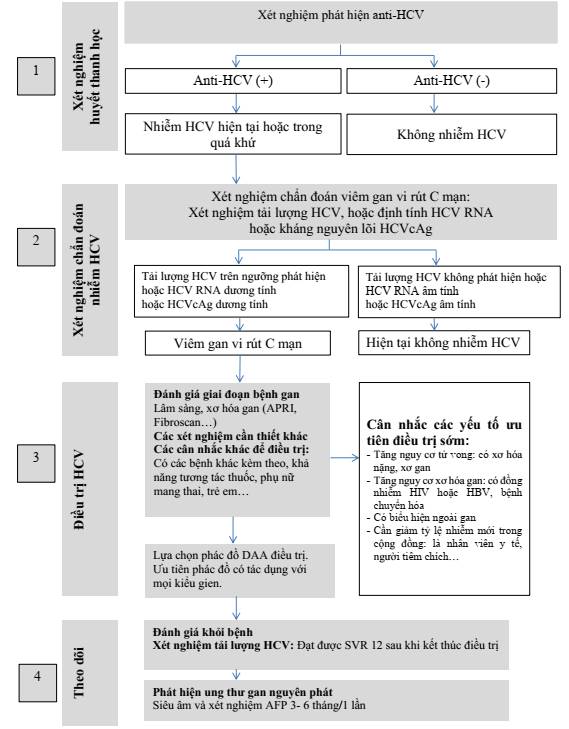
Hình 3: Chiến lược xét nghiệm phát hiện HCV
* Phiên giải kết quả:
- Người có kết quả xét nghiệm anti-HCV ( ) có nghĩa là đã từng nhiễm HCV hoặc đang hiện nhiễm HCV. Để chẩn đoán hiện nhiễm HCV cần được xét nghiệm HCV RNA hoặc HCVcAg (mục 2.2.2).
- Người có kết quả xét nghiệm anti-HCV (-) có nghĩa là không nhiễm HCV. Cần được tư vấn dự phòng nhiễm HCV. Cần xét nghiệm lại nếu vẫn tiếp tục có nguy cơ nhiễm HCV.
2.2.2. Xét nghiệm chẩn đoán nhiễm HCV
- Người bệnh có kết quả anti-HCV dương tính cần được xét nghiệm khẳng định tình trạng nhiễm HCV bằng một trong các xét nghiệm sau:
Xét nghiệm tải lượng HCV.
Xét nghiệm định tính HCV RNA.
Xét nghiệm phát hiện kháng nguyên lõi HCVcAg.
- Chẩn đoán nhiễm HCV khi:
Kết quả tải lượng HCV trên giới hạn phát hiện, hoặc
Định tính HCV RNA dương tính, hoặc
Kháng nguyên HCVcAg dương tính.
2.2.3. Xét nghiệm tải lượng HCV theo dõi điều trị viêm gan vi rút C
- Xét nghiệm tải lượng HCV tại tuần thứ 12 sau khi kết thúc điều trị:
Nếu tải lượng HCV dưới ngưỡng phát hiện ở tuần thứ 12 sau khi kết thúc điều trị là đạt được đáp ứng vi rút bền vững (Sustained Virus Response - SVR12).
Nếu tải lượng HCV trên ngưỡng phát hiện tại tuần thứ 12 sau khi kết thúc điều trị, là không đạt được SVR12, được xem là thất bại điều trị.
- Trong trường hợp người bệnh đã đạt đáp ứng vi rút bền vững nhưng vẫn tiếp tục có nguy cơ cao nhiễm HCV, có thể xét nghiệm lại HCV RNA để phát hiện tái nhiễm.
2.2.4. Xét nghiệm kiểu gien HCV
- Không khuyến cáo làm xét nghiệm kiểu gien để chỉ định điều trị vì hiện đã có thuốc kháng vi rút hiệu quả với tất cả các kiểu gien HCV (pangenotherapic).
- Chỉ định thực hiện xét nghiệm kiểu gien trong một số trường hợp người bệnh có nghi ngờ kháng thuốc.
1. Đặc điểm kỹ thuật cần được xem xét khi lựa chọn sinh phẩm xét nghiệm
1.1. Xét nghiệm chẩn đoán huyết thanh học
- Độ nhạy.
- Độ đặc hiệu.
- Độ nhạy phân tích/Giới hạn phát hiện.
- Độ chính xác.
1.2. Xét nghiệm sinh học phân tử
- Giới hạn phát hiện.
- Khả năng phát hiện các kiểu gien.
- Giới hạn định lượng (áp dụng với các xét nghiệm định lượng).
- Độ chính xác.
- Độ đúng.
Phải dựa trên danh mục sinh phẩm được Bộ Y tế cấp phép và tham khảo các kết quả đánh giá sinh phẩm của các tổ chức Quốc tế như chương trình tiền thẩm định của Tổ chức Y tế Thế giới, các thành viên của GHTF (Global Harmonization Task Force) gồm: Liên minh Châu Âu (European Union), Cơ quan Quản lý Dược và Thực phẩm Hoa Kỳ (US Food and Drug Administration), Bộ Y tế Canada (Health Canada), Cơ quan quản lý Hàng hoá Trị liệu Úc (Therapeutic Goods Administration (TGA) – Australia), Bộ Y tế, Lao động và Phúc lợi Nhật Bản (Japan Ministry of Health, Labour and Welfare).
Tiêu chuẩn lựa chọn sinh phẩm xét nghiệm huyết thanh học HBV và HCV của TCYTTG
| Dấu ấn xét nghiệm | Xét nghiệm men EIA | Xét nghiệm nhanh |
| HBsAg | Độ nhạy: 100% | Độ nhạy: 100% |
| Độ đặc hiệu: ≥ 98% | Độ đặc hiệu: ≥ 98% | |
|
| Độ chính xác (dao động giữa người đọc kết quả: ≤5%) | |
|
| Tỷ lệ phép thử hỏng: ≤5% | |
|
|
|
|
| anti-HCV | Độ nhạy: 100% | Độ nhạy: ≥ 98% |
| Độ đặc hiệu: ≥ 98% | Độ đặc hiệu: ≥ 97% | |
|
| Độ chính xác (dao động giữa người đọc kết quả: ≤5%) | |
|
| Tỷ lệ phép thử hỏng: ≤5% | |
|
|
|
|
3. Phòng xét nghiệm: cần xem xét định kỳ hàng năm về chất lượng sinh phẩm cho các chỉ tiêu xét nghiệm vi rút viêm gan B, C trong từng phương cách xét nghiệm. Các chỉ số đánh giá cần quan tâm như: tỷ lệ vật tư trong bộ sinh phẩm (lancet lấy máu, pipette hút mẫu…) bị lỗi, tỷ lệ xét nghiệm nhanh không đạt tiêu chuẩn chấp thuận kết quả, tỷ lệ xét nghiệm tự động bị lỗi theo từng loại mã code trên hệ thống xét nghiệm, tỷ lệ mẫu kiểm soát chất lượng (QC) ngoài giới hạn chấp nhận… Kết quả đánh giá này cần được báo cáo đến các đơn vị liên quan thực hiện cung cấp sinh phẩm.
1. Các cơ sở y tế thực hiện xét nghiệm chẩn đoán vi rút viêm gan B, C cần xây dựng và áp dụng hệ thống quản lý chất lượng toàn diện để đảm bảo kết quả xét nghiệm chính xác, kịp thời, chuẩn hoá hướng tới việc liên thông, công nhận kết quả xét nghiệm giữa các cơ sở y tế.
2. Các cơ sở y tế cần thực hiện quản lý chất lượng phòng xét nghiệm.
- Thông tư số 01/2013/TT-BYT ngày 11/01/2013 của Bộ trưởng Bộ Y tế về việc hướng dẫn quản lý chất lượng xét nghiệm tại các cơ sở khám bệnh, chữa bệnh.
- Tiêu chí đánh giá mức chất lượng phòng xét nghiệm y học, ban hành theo Quyết định số 2429/QĐ-BYT ngày 12 tháng 6 năm 2017.
- Tiêu chuẩn TCVN ISO 15189: 2014 - Phòng thí nghiệm y tế: Yêu cầu về chất lượng và năng lực.
3. Các cơ sở y tế cần đảm bảo cho phòng xét nghiệm có thực hiện xét nghiệm vi rút viêm gan B, C của cơ sở triển khai công tác quản lý chất lượng theo Tiêu chí đánh giá mức chất lượng phòng xét nghiệm y học, ban hành theo Quyết định số 2429/QĐ-BYT ngày 12 tháng 6 năm 2017.
4. Các cơ sở y tế phải đảm bảo có đủ nhân lực thực hiện các xét nghiệm chẩn đoán vi rút viêm gan B, C. Nhân lực được giao thực hiện xét nghiệm này phải được đào tạo có đủ kiến thức, kỹ năng phù hợp trước khi đảm nhận công việc, có đủ hồ sơ đào tạo.
5. Các phòng xét nghiệm phải xây dựng quy trình thực hiện xét nghiệm vi rút viêm gan B, C. Trong quy trình cần hướng dẫn rõ về lập hồ sơ và lưu hồ sơ xét nghiệm (nơi lưu trữ, thời gian lưu trữ...). Hồ sơ xét nghiệm cần có các thông tin: thời điểm thực hiện, người thực hiện, người phê duyệt, mã số bệnh phẩm, tên sinh phẩm và hạn sử dụng, kết quả mẫu kiểm soát chất lượng, kết quả xét nghiệm…
6. Các phòng xét nghiệm phải áp dụng các biện pháp kiểm soát chất lượng cho các quy trình xét nghiệm chẩn đoán vi rút viêm gan B, C.
7. Các phòng xét nghiệm phải tham gia chương trình ngoại kiểm cho các xét nghiệm chẩn đoán vi rút viêm gan B, C.
8. Các phòng xét nghiệm cần thực hiện đánh giá hàng năm về việc triển khai các quy trình xét nghiệm chẩn đoán vi rút viêm gan B, C: xem xét về mẫu bệnh phẩm, sinh phẩm sử dụng, kết quả kiểm soát chất lượng, kết quả tham gia ngoại kiểm, giá xét nghiệm…
1. Tổ chức hệ thống phòng xét nghiệm chẩn đoán vi rút viêm gan B, C
1.1. Tại các cơ sở y tế.
- Cơ sở chăm sóc sức khoẻ ban đầu: thực hiện xét nghiệm huyết thanh học bằng kỹ thuật xét nghiệm nhanh (RDT).
- Bệnh viện và các cơ sở y tế tuyến huyện: thực hiện xét nghiệm huyết thanh sử dụng kỹ thuật xét nghiệm nhanh (RDT), xét nghiệm tại phòng xét nghiệm: ELISA, CLIA, ECLIA, CMIA …và xét nghiệm sinh học phân tử tại điểm chăm sóc (Point of Care Test).
- Bệnh viện và các cơ sở y tế tuyến tỉnh, khu vực: thực hiện xét nghiệm huyết thanh sử dụng kỹ thuật xét nghiệm nhanh (RDT), xét nghiệm tại phòng xét nghiệm như ELISA, CLIA, ECLIA, CMIA…và xét nghiệm sinh học phân tử tại điểm chăm sóc (Point of Care Test), xét nghiệm sinh học phân tử tại phòng xét nghiệm (laboratory-based).
1.2. Tại cộng đồng
Xét nghiệm sàng lọc vi rút viêm gan B, C khi triển khai ở cộng đồng sử dụng các test nhanh, lấy máu đầu ngón tay hoặc dịch miệng.
2.1. Kiện toàn các điều kiện cơ sở vật chất, nhân lực đáp ứng yêu cầu đề ra trong hướng dẫn cho các loại xét nghiệm mà cơ sở thực hiện.
2.2. Thực hiện xét nghiệm, tư vấn, kết nối người bệnh với các cơ sở điều trị viêm gan vi rút tuân thủ theo hướng dẫn.
2.3. Thực hiện các hoạt động đảm bảo chất lượng xét nghiệm, tham gia chương trình ngoại kiểm cho các xét nghiệm mà cơ sở đang thực hiện.
2.4. Tham mưu cho các cơ quan quản lý trực thuộc: Sở Y tế, Bệnh viện, Trung tâm y tế…về đáp ứng nhu cầu đào tạo, hỗ trợ kỹ thuật, kiểm tra đánh giá chất lượng và cung ứng sinh phẩm đảm bảo chất lượng.
3. Trách nhiệm của Sở Y tế tỉnh/thành phố
3.1. Chỉ đạo triển khai việc thực hiện xét nghiệm vi rút viêm gan B, C tại các cơ sở y tế trên địa bàn tỉnh theo hướng dẫn.
3.2. Chỉ đạo, phối hợp với đơn vị có cơ sở xét nghiệm vi rút viêm gan B, C xây dựng kế hoạch đào tạo, tổ chức đào tạo cho cán bộ xét nghiệm vi rút viêm gan của các cơ sở y tế tại địa bàn tỉnh/thành phố.
3.3. Kiến nghị sửa đổi, bổ sung nhằm khắc phục các bất cập liên quan đến thực hiện bảo đảm chất lượng xét nghiệm vi rút viêm gan trong quá trình thực hiện.
3.4. Tổ chức giám sát việc triển khai xét nghiệm vi rút viêm gan B, C trên địa bàn tỉnh/thành phố.
3.5. Định kỳ hằng năm, báo cáo Bộ Y tế danh sách các cơ sở xét nghiệm thực hiện xét nghiệm vi rút viêm gan B, C trên địa bàn tỉnh/thành phố.
4. Trách nhiệm của Viện, Bệnh viện Trung ương
4.1. Xây dựng gói chương trình đào tạo liên tục về xét nghiệm vi rút viêm gan B, C.
4.2. Lồng ghép hoạt động đào tạo, hỗ trợ kỹ thuật, đánh giá thực hiện xét nghiệm vi rút viêm gan B, C vào công tác chỉ đạo tuyến của đơn vị.
4.3. Cử cán bộ thực hiện đào tạo, hỗ trợ kỹ thuật cho tuyến dưới khi được yêu cầu.
5. Trách nhiệm của Cục Quản lý Khám chữa bệnh - Bộ Y tế
5.1. Trực tiếp chỉ đạo tổ chức triển khai thực hiện hướng dẫn xét nghiệm vi rút viêm gan B, C trên phạm vi toàn quốc.
5.2. Xây dựng phòng tham chiếu quốc gia về xét nghiệm vi rút viêm gan B, C, phát triển tài liệu đào tạo xét nghiệm vi rút viêm gan B, C, tổ chức triển khai chương trình ngoại kiểm đánh giá chất lượng xét nghiệm, hỗ trợ kỹ thuật.
5.3. Huy động nguồn lực từ các tổ chức quốc tế nhằm nâng cao chất lượng, hiệu quả công tác xét nghiệm vi rút viêm gan B, C cho cộng đồng.
Phụ lục 1. XÉT NGHIỆM TRONG CHẨN ĐOÁN VÀ TRỊ VIÊM GAN VI RÚT B MẠN
(Ban hành kèm theo Quyết định số 1868/QĐ-BYT ngày 24 tháng 4 năm 2020 của Bộ trưởng Bộ Y tế)

Phụ lục 2. XÉT NGHIỆM TRONG CHẨN ĐOÁN VÀ TRỊ VIÊM GAN VI RÚT C
(Ban hành kèm theo Quyết định số 1868/QĐ-BYT ngày 24 tháng 4 năm 2020 của Bộ trưởng Bộ Y tế)
Phụ lục 3: HƯỚNG DẪN THU THẬP VÀ QUẢN LÝ BỆNH PHẨM XÉT NGHIỆM VI RÚT VIÊM GAN B, C
(Ban hành kèm theo Quyết định số 1868/QĐ-BYT ngày 24 tháng 4 năm 2020 của Bộ trưởng Bộ Y tế)
1. Các loại mẫu xét nghiệm và yêu cầu xử lý, bảo quản mẫu:
| Loại mẫu | Yêu cầu về thời gian xử lý, bảo quản, xét nghiệm |
| Mẫu máu tĩnh mạch toàn phần | Xét nghiệm ngay |
| Huyết thanh | - Không sử dụng chất chống đông khi thu thập mẫu máu toàn phần - Tách huyết thanh trong vòng 24 giờ - Bảo quản 2-80C - Xét nghiệm huyết thanh học trong vòng 5 ngày, hoặc theo hướng dẫn sử dụng sinh phẩm xét nghiệm |
| Huyết tương | - Sử dụng chất chống đông khi thu thập mẫu máu toàn phần. Lựa chọn chất chống đông phù hợp theo hướng dẫn sử dụng sinh phẩm xét nghiệm - Tách huyết tương trong vòng 6 giờ hoặc theo hướng dẫn của bộ sinh phẩm xét nghiệm - Bảo quản 2-80C - Xét nghiệm huyết thanh học trong vòng 5 ngày, hoặc theo hướng dẫn sử dụng sinh phẩm xét nghiệm - Xét nghiệm sinh học phân tử được thực hiện với mẫu huyết tương, không sử dụng chống đông heparin, mẫu bảo quản ở -200C (cho xét nghiệm DNA), ở -800C (cho xét nghiệm RNA) |
| Máu mao mạch đầu ngón tay | - Sử dụng ống mao quản theo hướng dẫn - Ống mao quản có chất chống đông phù hợp, có vạch thể tích - Mẫu cần xét nghiệm ngay |
| Dịch miệng (dịch tiết từ lợi) | - Sử dụng dụng cụ lấy dịch miệng theo hướng dẫn của nhà sản xuất - Mẫu cần xét nghiệm ngay |
| Giọt máu khô: Máu toàn phần tĩnh mạch hoặc máu đầu ngón tay được nhỏ lên bìa thấm, làm khô tự nhiên | - Bảo quản 40C tới 3 tháng, bảo quản lâu hơn ở -200C - Chỉ được sử dụng mẫu DBS khi loại mẫu này đã được nhà sản xuất sinh phẩm thẩm định |
Phải tuân thủ các yêu cầu về loại mẫu xét nghiệm, kiện bảo quản mẫu nêu trong hướng dẫn sử dụng sinh phẩm của nhà sản xuất.
2. Kỹ thuật lấy mẫu
2.1. Lấy máu đầu ngón tay
2.1.1. Chuẩn bị dụng cụ: Kim/lưỡi chích dùng một lần có lẫy (lancet) chuyên dụng, ống mao quản có thể tích phù hợp, găng tay, bông thấm nước vô trùng, cồn 70 độ hoặc cồn I ốt, băng cá nhân, thùng đựng chất thải theo quy định.
2.1.2. Chuẩn bị lấy máu
- Nhân viên xét nghiệm điền đầy đủ các thông tin của người được làm xét nghiệm (họ tên hoặc mã số và năm sinh/tuổi) và ngày lấy mẫu vào phiếu xét nghiệm và trên thanh xét nghiệm (trong trường hợp cần thiết), sát trùng tay và đeo găng tay.
2.1.3. Các bước thao tác
- Xác định vị trí chích máu: Vị trí chích máu tốt nhất là mặt bên (trái hoặc phải của ngón tay thứ 3 (ngón giữa) hoặc thứ 4 (ngón áp út);
- Người được làm xét nghiệm duỗi bàn tay xuống phía dưới;
- Sát khuẩn vị trí lấy máu bằng cồn 70 độ và để khô trong vòng 30 giây;
- Để kim/lưỡi chích vuông góc với mặt da đầu ngón tay ấn lẫy nhanh, mạnh dứt khoát. Đảm bảo giữ kim chích đúng góc và không làm nghiêng;
- Lau bỏ giọt máu đầu tiên (vì giọt máu đầu tiên thường có nhiều dịch tổ chức, tế bào có thể ảnh hưởng đến kết quả xét nghiệm);
- Đợi cho đến khi máu chảy thành giọt lớn, dùng ống mao quản hút đủ thể tích yêu cầu (không bóp nặn xung quanh chỗ chích máu để tránh tăng tiết dịch tổ chức mô ảnh hưởng đến chất lượng mẫu);
- Bỏ kim/lưỡi chích vào hộp đựng các vật sắc nhọn và ống mao quản đã dùng hút mẫu máu vào hộp đựng rác thải y tế;
- Sát trùng lại vị trí đã lấy máu bằng cồn 70 độ và băng lại;
- Mẫu sau khi lấy cần tiến hành xét nghiệm theo hướng dẫn của nhà sản xuất.
2.2. Lấy máu tĩnh mạch
2.2.1. Chuẩn bị dụng cụ
- Bơm kim tiêm vô trùng (có thể dùng bơm kim tiêm loại 5ml, kim cỡ 21G - 23G), hoặc bộ dụng cụ lấy máu hút chân không (kim, giá đỡ), ống hút chân không có thể tích và chất chống đông phù hợp với các xét nghiệm cần thực hiện, pipette pasteur nhựa dùng 1 lần (pipette có quả bóp gắn liền), ống đựng huyết thanh/huyết tương (nên sử dụng ống nhựa, thể tích 1,5 ml - 2,0 ml, nắp xoáy, có khả năng chịu được nhiệt độ âm nếu mẫu cần bảo quản nhiệt độ âm), găng tay, khẩu trang, dây ga rô, bông thấm nước vô trùng, cồn 70 độ, bút dạ (loại mực chịu nước), giá để ống nghiệm, thùng đựng các vật sắc nhọn và chất thải y tế.
- Lưu ý, dụng cụ lấy mẫu cho xét nghiệm sinh học phân tử phải đạt tiêu chuẩn không có DNase/RNase.
2.2.2. Chuẩn bị lấy máu
Nhân viên lấy mẫu điền đầy đủ các thông tin của người được làm xét nghiệm (họ tên hoặc mã số và năm sinh/tuổi) và ngày lấy mẫu, người lấy mẫu, giờ lấy mẫu vào phiếu xét nghiệm và trên thanh xét nghiệm (trong trường hợp cần thiết), sát trùng tay và đeo găng tay.
2.2.3. Các bước thao tác
- Xác định vị trí lấy máu (tĩnh mạch), buộc băng garô phía trên vị trí lấy máu và sát khuẩn bằng cồn 70 độ và để khô trong vòng 30 giây;
- Luồn kim vào tĩnh mạch:
Nếu dùng bơm tiêm: rút pít tông từ từ cho đến khi đủ thể tích máu cho các chỉ định xét nghiệm. Rút bơm tiêm, tháo kim, để bơm tiêm chếch với thành ống nghiệm và bơm từ từ cho máu chảy theo thành ống nghiệm tránh làm vỡ hồng cầu.
Nếu lấy máu bằng bộ dụng cụ hút chân không, sau khi luồn kim vào tĩnh mạch, có máu chảy ra trong ống dẫn, cắm đầu ống dẫn qua nắp ống hút chân không (vacutainer), để máu được hút vào ống cho đến khi đủ thể tích cần lấy. Cần lấy máu bằng kỹ thuật hút chân không cho các xét nghiệm sinh học phân tử để tránh tạp nhiễm cho mẫu máu xét nghiệm.
- Tháo bỏ đầu kim vào hộp đựng các vật sắc nhọn và bơm tiêm hoặc giá đỡ ống lấy máu bẩn vào hộp đựng rác thải y tế;
- Sát trùng lại vị trí lấy máu bằng cồn 70 độ và băng lại.
2.2.4. Tách huyết thanh/huyết tương
- Giữ ống máu ổn định ở nhiệt độ phòng tối thiểu 30 phút mới tiến hành tách huyết thanh/huyết tương nhưng không quá 2 giờ. Khi không tách được huyết thanh/huyết tương trong vòng 2 giờ, mẫu sau khi để ổn định ở nhiệt độ phòng 30 phút chuyển bảo quản ở nhiệt độ 4oC - 8oC. Tách huyết thanh/huyết tương trong vòng tối đa 24 giờ. Mẫu xét nghiệm sinh học phân tử, tách huyết thanh/huyết tương thực hiện trong vòng 6 giờ hoặc theo hướng dẫn của bộ sinh phẩm xét nghiệm.
- Nếu có máy ly tâm: Tốc độ và thời gian ly tâm 2.000 – 2.500 vòng/phút trong 10 phút. Khi xếp ống máu vào máy phải đảm bảo cân bằng ở các vị trí đối xứng. Dùng pipette hút phần huyết thanh/huyết tương sang ống lưu mẫu có mã số tương ứng.
- Không có máy ly tâm: Tách huyết thanh/huyết tương khi thấy mẫu đã được phân tách rõ ràng.
- Kiểm tra thể tích huyết thanh/huyết tương thu được đủ cho các yêu cầu xét nghiệm được chỉ định
3. Vận chuyển mẫu
- Vận chuyển mẫu trong nội bộ cơ sở y tế từ địa điểm thu thập mẫu tới phòng xét nghiệm phải đảm bảo an toàn, tuân thủ theo hướng dẫn hiện hành của cơ sở. Khi cần chuyển gửi mẫu tới các phòng xét nghiệm khác ngoài cơ sở y tế thu thập mẫu ban đầu phải tuân thủ các hướng dẫn về đóng gói, vận chuyển dưới đây.
3.1. Đóng gói mẫu
3.1.1. Đóng gói 3 lớp
- Lớp 1 (ống đựng mẫu): Đeo găng tay đóng chặt các nắp của ống mẫu và xếp tất cả các ống mẫu theo phương thẳng đứng vào trong giá đựng mẫu. Dùng băng dính cố định các ống mẫu trong giá đựng bệnh phẩm (nếu cần).
- Lớp 2 (túi, hộp, gói bằng vật liệu bền không thấm nước, không rò rỉ, chịu được nhiệt độ 40-55oC): Cho đủ vật liệu thấm hút (bông thấm nước hoặc giấy thấm) vào giữa lớp thứ 1 và lớp thứ 2, để trong trường hợp đổ vỡ vật liệu thấm hút sẽ hấp thụ toàn bộ lượng mẫu.
- Lớp ngoài cùng (hộp, thùng cứng, chịu được va đập, không rò rỉ). Giữa lớp thứ 2 và lớp ngoài cùng có các túi tích lạnh để đảm bảo mẫu được bảo quản từ 4oC-8oC trong quá trình vận chuyển. Trong trường hợp mẫu vận chuyển ở nhiệt độ âm sâu cần sử dụng đá khô để vận chuyển, nếu dùng đá khô thì lớp ngoài cùng cần có lỗ thoát khí CO2.
3.1.2. Đóng nắp thùng đựng mẫu và chốt khóa lại. Trường hợp không có chốt khóa thì dùng băng dính dán xung quanh.
3.1.3. Dán hoặc in ký hiệu nguy hiểm sinh học và số điện thoại liên hệ trong trường hợp khẩn cấp bên ngoài của hộp đựng mẫu bệnh phẩm.
Lưu ý: Không để danh sách mẫu vào trong hộp vận chuyển mẫu.
3.2. Vận chuyển mẫu
3.2.1. Vận chuyển mẫu bệnh phẩm phải tuân thủ các quy định của quốc gia và chính quyền địa phương về vận chuyển các tác nhân có khả năng gây bệnh.
3.2.2. Gọi điện báo trước cho phòng xét nghiệm biết thời gian bệnh phẩm sẽ tới để phòng xét nghiệm bố trí tiếp nhận.
3.2.3. Bệnh phẩm gửi đi phải kèm theo phiếu yêu cầu xét nghiệm điền đầy đủ các thông tin.
3.2.4. Mẫu bệnh phẩm phải được bảo quản lạnh trong suốt quá trình vận chuyển.
3.2.5. Trong quá trình vận chuyển mẫu phải buộc chặt hộp chứa mẫu bệnh phẩm vào giá chở hàng, đảm bảo gọn gàng, tránh đổ, vỡ.
3.3. Tiếp nhận mẫu
3.3.1. Kiểm tra nhiệt độ trong hộp vận chuyển, kiểm tra phát hiện ống đựng mẫu được đậy kín, không bị nứt vỡ, đánh giá tình trạng mẫu: máu bị đông, tán huyết, thể tích, đối chiếu thông tin trên ống đựng máu, phiếu xét nghiệm.
3.3.2. Thông báo cho đơn vị gửi mẫu khi phát hiện thấy các điểm không phù hợp liên quan đến mẫu bệnh phẩm chuyển gửi. Xác nhận lại các thông tin, yêu cầu lấy lại mẫu… nếu cần thiết. Trong trường hợp có sự sai lệch giữa thông tin trên phiếu và trên ống mẫu đơn vị gửi mẫu cần xác nhận thông tin đúng, hoặc kết quả sẽ trả theo thông tin trên ống đựng mẫu.
3.3.3. Ký nhận vào phiếu gửi mẫu và ghi chép vào sổ nhận mẫu các thông tin về số lượng mẫu, người nhận, thời gian nhận.
3.4. Xử lý tràn đổ
Khi tiếp nhận mẫu bệnh phẩm nếu phát hiện thấy ống mẫu bị nứt vỡ, bật nắp gây tràn, đổ, rò rỉ mẫu ra ngoài, PXN cần xử lý tràn đổ bệnh phẩm theo quy trình xử lý dung dịch chứa tác nhân gây bệnh mà PXN đã ban hành.
4. Bảo quản mẫu
Mẫu huyết thanh/huyết tương nếu xét nghiệm trong vòng 3-7 ngày phải bảo quản ở nhiệt độ 4oC-8oC (tùy thuộc vào hướng dẫn của nhà sản xuất). Nếu cần bảo quản lâu hơn phải lưu trữ ở nhiệt độ (- 20oC) hoặc lạnh hơn. Tuy nhiên mẫu không được tan đông quá 3 lần.
5. Tiêu hủy mẫu
Tiêu hủy mẫu xét nghiệm tuân thủ theo quy định tại Thông tư liên tịch số 58/2015/TTLT-BYT- BTNMT ngày 31/12/2015 của Bộ Y tế và Bộ Tài nguyên và môi trường quy định về quản lý chất thải y tế.
Phụ lục 4: HƯỚNG DẪN CHUNG THỰC HIỆN XÉT NGHIỆM
(Ban hành kèm theo Quyết định số 1868/QĐ-BYT ngày 24 tháng 4 năm 2020 của Bộ trưởng Bộ Y tế)
1. Phòng xét nghiệm phải xây dựng quy trình thực hiện chuẩn (SOP) cho từng chỉ tiêu xét nghiệm, có đủ các nội dung theo quy định trong Tiêu chí đánh giá mức chất lượng phòng xét nghiệm y học, ban hành theo quyết định số 2429/QĐ-BYT ngày 12 tháng 6 năm 2017.
2. Nên có lưu đồ thực hiện xét nghiệm, tóm tắt các công đoạn của quy trình xét nghiệm:
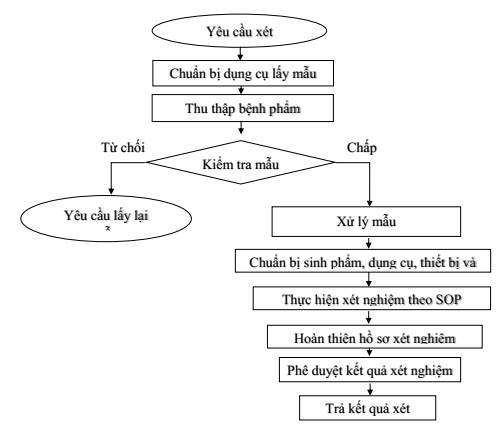
Hình 4: Minh hoạ lưu đồ thực hiện xét nghiệm
3. Thực hiện xét nghiệm theo đúng quy trình xét nghiệm đã được phê duyệt
4. Lập đầy đủ hồ sơ cho quá trình xét nghiệm, sử dụng biểu mẫu được quy định trong quy trình xét nghiệm đã được phê duyệt
5. Kết quả xét nghiệm phải được xem xét và phê duyệt bởi cá nhân đã được phân công.
Kết quả xét nghiệm mẫu bệnh phẩm chỉ được công nhận khi các kết quả kiểm soát chất lượng đạt yêu cầu.
6. Trả kết quả xét nghiệm theo quy trình phòng xét nghiệm đã ban hành. Theo kết quả xét nghiệm, nên có tư vấn phòng bệnh hoặc kết nối bệnh nhân với các cơ sở chăm sóc điều trị.
7. Lưu mẫu bệnh phẩm theo quy định của phòng xét nghiệm.
8. Lưu hồ sơ xét nghiệm theo quy định của phòng xét nghiệm.
9. Xử lý chất thải theo quy định của phòng xét nghiệm.
Phụ lục 5: QUY ĐỊNH THỰC HÀNH TỐT TRONG XÉT NGHIỆM CHẨN ĐOÁN PHÂN TỬ
(Ban hành kèm theo Quyết định số 1868/QĐ-BYT ngày 24 tháng 4 năm 2020 của Bộ trưởng Bộ Y tế)
1. Nhân sự
Nhân viên phòng xét nghiệm chẩn đoán phân tử phải có kiến thức và kỹ năng cơ bản về sinh học phân tử, được đào tạo phù hợp và được đánh giá có đủ khả năng trước khi nhận thực hiện xét nghiệm được giao.
2. Tổ chức khu vực làm việc
2.1. Phòng xét nghiệm sinh học phân tử cần được phân chia thành các khu vực riêng biệt cho các công việc sau:
- Phòng chuẩn bị sinh phẩm
- Phòng tách chiết axit nuleic
- Phòng khuyếch đại gien
- Phòng phân tích sản phẩm gien khuyếch đại
Các phòng xét nghiệm có thực hiện xét nghiệm sinh học phân tử truyền thống (không sử dụng hệ thống xét nghiệm sinh học phân tử tự động, bán tự động) phải tuân thủ chặt chẽ nguyên tắc phân chia khu vực làm việc như trên. Các phòng xét nghiệm sử dụng hệ thống xét nghiệm sinh học phân tử tự động, bán tự động, việc phân chia/tích hợp khu vực làm việc cần được xem xét phù hợp.
2.2. Mỗi khu vực làm việc cần được bố trí đủ trang thiết bị, dụng cụ, bảo hộ cá nhân, không sử dụng lẫn giữa các khu vực. Nên dùng dấu hiệu dễ nhận biết để phân biệt thiết bị, dụng cụ, đồ dùng của từng khu vực tránh dùng lẫn.
3. Thực hành tốt
3.1. Vật tư tiêu hao
- Không sử dụng găng tay có bột tan.
- Sử dụng các loại ống lấy mẫu, ống đựng mẫu, đầu tip micropipette không có DNAse và RNAase. Khuyến khích sử dụng các loại ống nắp xoáy giúp hạn chế tạo và phát tán vi giọt khi thao tác đóng mở ống nắp bật.
- Sử dụng các loại ống lấy mẫu có chất chống đông phù hợp.
- Dung dịch khử nhiễm: Cần có sẵn các dung dịch khử nhiễm loai bỏ DNA/RNA trên bề mặt thiết bị, bàn thí nghiệm, dụng cụ như dung dịch tẩy 1% (bleach solution 1%), ethanol 70%, các sản phẩm loại bỏ DNAse/RNAse…
3.2. Chuẩn bị sinh phẩm
- Phòng chuẩn bị sinh phẩm cần được lắp đặt đèn UV để khử nhiễm. Trang thiết bị và dụng cụ tối thiểu gồm: tủ PCR, máy lắc (vortex), máy ly tâm (spindown), bộ micropipet. Nếu có bảo quản sinh phẩm trong khu vực này, cần có tủ mát 40, tủ âm -200 C.
- Bảo quản sinh phẩm ở nhiệt độ theo quy định của nhà sản xuất. Không bảo quản sinh phẩm trong cùng thiết bị bảo quản lạnh tủ 40, -200 C bảo quản mẫu bệnh phẩm, sản phẩm tách chiết, sản phẩm PCR.
- Sinh phẩm và vật tư tiêu hao phải được cung ứng trực tiếp từ nơi bảo quản tới phòng chuẩn bị sinh phẩm và không sử dụng chung với các phòng khác.
- Chuẩn bị sinh phẩm, hỗn hợp phản ứng phải được tiến hành trong tủ PCR.
- Không mang mẫu bệnh phẩm, mẫu tách chiết DNA/RNA, sản phẩm PCR vào phòng chuẩn bị sinh phẩm.
3.3. Tách chiết DNA/RNA
- Phòng tách chiết axit nuleic cần được trang bị thiết bị và dụng cụ tối thiểu gồm: tủ an toàn sinh học cấp II, máy ly tâm tube 1,5 ml - 2,0 ml, bộ micropipet. Nếu có bảo quản sản phẩm tách chiết trong khu vực này, cần có tủ mát 40, tủ âm -200 C.
- Tách chiết DNA/RNA cần phải được tiến hành trong tủ an toàn sinh học.
- Nên sử dụng riêng bộ micropipette, máy ly tâm cho tách chiết DNA và RNA.
3.4. Khuyếch đại gien
- Phòng khuyếch đại gien được trang bị các thiết bị khuyếch đại gien phù hợp với các loại xét nghiệm được thực hiện như máy PCR, máy real-time PCR, máy giải trình tự gien... Cần đảm bảo nhiệt độ, độ ẩm phù hợp cho các thiết bị.
- Cần có buồng PCR nếu phòng xét nghiệm có thực hiện các xét nghiệm trong đó sản phẩm PCR được dùng làm khuôn cho một phản ứng PCR khác như nested- PCR…
- Nếu có bảo quản sản phẩm PCR trong khu vực này, cần có tủ mát 40C, tủ âm -200C. Không bảo quản sản phẩm PCR cùng với mẫu bệnh phẩm, sản phẩm tách chiết.
3.5. Phân tích sản phẩm gien khuếch đại
- Phòng phân tích sản phẩm PCR cần được trang bị các thiết bị: hệ thống điện di gel agarose, máy chụp ảnh gel, lò vi sóng…
- Cần cởi áo choàng, bỏ găng tay, rửa tay trước khi ra khỏi khu vực này.
3.6. Thực hiện xét nghiệm SHPT theo nguyên tắc một chiều từ khu vực sạch đến khu vực tạp nhiễm: Chuẩn bị hoá chất → Tách chiết axit nucleic → Khuyếch đại gien → Phân tích sản phẩm khuyếch đại, không đi theo chiều ngược lại.
4. Chống tạp nhiễm
Phòng xét nghiệm cần xây dựng hướng dẫn về chống tạp nhiễm, quy định cụ thể:
- Khử nhiễm bề mặt làm việc.
- Khử nhiễm thiết bị như máy ly tâm các loại, máy PCR….
- Khử nhiễm dụng cụ: micropipette, giá đỡ ống nghiệm, hộp đựng mẫu…
- Khử nhiễm buồng PCR, tủ an toàn sinh học.
5. Mẫu kiểm soát chất lượng
- Mẫu chứng dương kiểm soát khuyếch đại: Là những mẫu tách chiết có kết quả khuyếch đại yếu, nhưng ổn định trong giới hạn có thể chấp nhận. Sử dụng các mẫu tách chiết có kết quả dương tính mạnh là nguy cơ gây tạp nhiễm.
- Nếu dùng plasmid làm mẫu kiểm soát chất lượng cho bước khuyếch đại cần phải pha loãng đến nồng độ cho kết quả dương tính yếu.
- Mẫu chứng âm cho bước khuyếch đại có thể dùng nước không có nuclease, để kiểm soát sự tạp nhiễm trong hỗn hợp phản ứng.
- Mẫu kiểm soát chất lượng bước tách chiết: Là các mẫu có kết quả dương tính và âm tính đã biết trước, được tách chiết và phân tích song song cùng mẫu bệnh phẩm để kiểm soát sự thành công của bước tách chiết và kiểm tra sự tạp nhiễm có thể xảy ra trong bước tách chiết.
- Vật liệu nội chứng: Được sử dụng để kiểm soát các yếu tố gây ức chế phản ứng PCR, hoặc chất lượng lần tách chiết. Vật liệu nội chứng có thể được bổ sung vào mẫu xét nghiệm trước hoặc sau tách chiết. Tốt nhất vật liệu nội chứng nên bổ sung vào mẫu trước khi tách DNA/RNA giúp kiểm soát cả quá trình tách chiết và khuyếch đại.
Tuân thủ theo hướng dẫn của nhà sản xuất sinh phẩm về sử dụng vật liệu nội chứng khi thực hiện xét nghiệm. Với xét nghiệm tự xây dựng (In-house), loại vật liệu nội chứng, hàm lượng và cách sử dụng phải được xác định trong quá trình thẩm định quy trình xét nghiệm.
DANH MỤC VIẾT TẮT
Viết tắt Giải nghĩa
| ALP | Alkaline phosphatase |
| ALT | Alanine aminotransferase |
| anti-HBc IgG | Kháng thể anti-HBc IgG |
| anti-HBc IgM | Kháng thể anti-HBc IgM |
| anti-HBe | Kháng thể anti-Hbe |
| anti-HBs | Kháng thể anti-HBs |
| anti-HCV | Kháng thể anti-HCV |
| APRI | Aminotransferase/platelet ratio index |
| ART | Antiretroviral therapy |
| ARV | Antiretroviral (drug) |
| AST | Aspartate aminotransferase |
| CLIA | Chemiluminescence immunoassay |
| CMIA | Chemiluminesence microparticle Immunoassays |
| DAA | Direct-acting antiviral (drug) DBS Dried blood spot (specimen) |
| ECL | Electrochemiluminescence immunoassay |
| ECLIA | Electrochemoluminescence Immunoassay |
| EIA | Enzyme immunoassay |
| ELISA | Enzyme-linked immunosorbent assay |
| EQAS | External quality assessment scheme |
| FDA US | Food and Drug Administration, U.S |
| HBeAg | Hepatitis B e antigen - Kháng nguyên HbeAg |
| HBsAg | Hepatitis B surface antigen - Kháng nguyên HbsAg |
| HBV | Hepatitis B virus - Vi rút viêm gan B |
| HBV DNA | Vật liệu di truyền DNA của HBV |
| HCC | Hepatocellular carcinoma - Ung thư tế bào biểu mô gan |
| HCV | Hepatitis C virus - Vi rút viêm gan C |
| HCVcAg | Hepatitis C virus core antigen - Kháng nguyên HCVcAg |
| HCV RNA | Vật liệu di truyền RNA của HCV |
| HIV | Human immunodeficiency virus - Vi rút HIV |
| MEIA | Microparticle enzyme Immunoassays |
| PCR | Polymerase Chain Reaction - Phản ứng PCR |
| PXN | Phòng xét nghiệm |
| POC test | Point-of-Care Test - Xét nghiệm tại điểm |
| RDT | Rapid Diagnostic Test - Xét nghiệm nhanh |
| SHPT | Sinh học phân tử |
| TCYTTG | Tổ chức Y tế Thế giới |
| XN | Xét nghiệm |
- 1 Quyết định 774/QĐ-BYT năm 2020 về danh mục 02 sinh phẩm chẩn đoán invitro xét nghiệm vi rút Corona (SARS-CoV-2) được cấp số đăng ký do Bộ trưởng Bộ Y tế ban hành
- 2 Công văn 3982/BYT-DP năm 2020 về thực hiện xét nghiệm vi rút SARS-Cov-2 do Bộ Y tế ban hành
- 3 Công điện 1183/CĐ-BYT năm 2020 về xét nghiệm vi rút SARS-CoV-2 do Bộ Y tế ban hành

