| BỘ Y TẾ | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 3349/2001/QĐ-BYT | Hà Nội, ngày 31 tháng 7 năm 2001 |
VỀ VIỆC BAN HÀNH "THƯỜNG QUY KỸ THUẬT ĐỊNH LƯỢNG VIBRIO PARAHAEMOLYTICUS TRONG THỰC PHẨM"
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ theo Nghị định số 68/ CP ngày 11/10/1993 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và tổ chức bộ máy của Bộ Y tế;
Căn cứ theo Nghị định số 86/CP ngày 08/12/1995 của Chính phủ về việc phân công trách nhiệm quản lý nhà nước đối với chất lượng hàng hóa;
Căn cứ theo Quyết định số 14/1999/QĐ-TTg ngày 04/02/1999 của Thủ tướng Chính phủ về việc thành lập Cục Quản lý chất lượng vệ sinh an toàn thực phẩm;
Theo đề nghị của Chánh văn phòng, Vụ trưởng Vụ Khoa học Đào tạo, Vụ trưởng Vụ Pháp chế, Chánh thanh tra - Bộ Y tế và Cục trưởng Cục Quản lý chất lượng vệ sinh an toàn thực phẩm,
QUYẾT ĐỊNH
Điều 1. Ban hành kèm theo Quyết định này “Thường quy kỹ thuật định lượng Vibrio parahaemolyticus trong thực phẩm”.
Điều 2. Quyết định này có hiệu lực kể từ ngày ký ban hành.
Điều 3. Các ông, bà: Chánh văn phòng, Chánh thanh tra, Vụ trưởng các Vụ: Khoa học Đào tạo, Pháp chế, Y tế dự phòng - Bộ Y tế; Cục trưởng Cục Quản lý chất lượng vệ sinh an toàn thực phẩm, Giám đốc Sở Y tế các Tỉnh,Thành phố trực thuộc Trung ương và Thủ trưởng các đơn vị trực thuộc Bộ Y tế chịu trách nhiệm thi hành Quyết định này.
|
| KT. BỘ TRƯỞNG BỘ Y TẾ |
ĐỊNH LƯỢNG VIBRIO PARAHAEMOLYTICUS TRONG THỰC PHẨM
(Ban hành kèm theo Quyết định số 3349/2001 QĐ-BYT ngày 31 tháng 7 năm 2001 của Bộ trưởng Bộ Y tế)
I. NGUYÊN LÝ PHƯƠNG PHÁP
Vibrio parahaemolyticus phát triển được trong môi trường có nồng độ muối cao. Lựa chọn khuẩn lạc V. parahaemolyticus xác định tính chất sinh vật hoá học theo thường quy.
II. PHẠM VI ÁP DỤNG
Phát hiện các ô nhiễm do Vibrio parahaemolyticus trong sản phẩm thuỷ sản và thức ăn chế biến sẵn.
III. DỤNG CỤ, MÔI TRƯỜNG, THUỐC THỬ
1. Dụng cụ thiết bị
Các dụng cụ và thiết bị thông thường trong phòng kiểm nghiệm vi sinh vật.
2. Môi trường, thuốc thử
- Thạch TCBS (Thiosunfat - Citrat - Bile - Salt - Sucroza)
- Thạch Tryple sugar iron (TSI)
- Thạch Wagatsuma
- Môi trường Clark - lubs
- Canh thang Trypticase Soy (TSB)
- Thạch Trypticase Soy (TSA)
- Canh thang muối glucoza (GSTB)
- Canh thang Glucose Hugh Leifson (HLGB)
- Môi trường di động
- Môi trường đường có chỉ thị màu bromocresol
(Các đường manitol, lactoza, sacaroza, arabinoza)
- Môi trường decarboxylaza (ADH, LDC, ODC)
- Thuốc thử hoặc giấy thử Oxidaza
- KOH, a naphton
- Dầu parafin vô trùng
- Thuốc nhuộm Gram
Chú ý: tất cả các loại môi trường phải có ít nhất 3% muối NaCl
IV. CHUẨN BỊ MÔI TRƯỜNG, THUỐC THỬ
1. Chuẩn bị môi trường
Môi trường nuôi cấy, canh thang, nước pha loãng và môi trường sinh vật hoá học được điều chế theo công thức. Các môi trường được đóng sẵn vào bình cầu, bình nón, ống nghiệm và được hấp tiệt trùng (110oC/30 phút hoặc 121oC/15 phút). ( Phụ lục kèm theo)
2. Chuẩn bị mẫu và dung dịch mẫu thử
2.1. Chuẩn bị mẫu
Mẫu thực phẩm được cắt nhỏ hoặc xay nhuyễn bằng máy trong điều kiện vô trùng cho tới khi được thể đồng nhất.
Lưu ý:
- Cá: Thịt cá, ruột và mang cá.
- Sò, hến: Toàn bộ cơ quan nội tạng.
- Tôm, cua : Thịt và cơ quan nội tạng. Nếu cần có thể tách riêng xét nghiệm các bộ phận của chúng (ruột, mang, gạch...).
Trước khi xét nghiệm, phải làm tan băng.
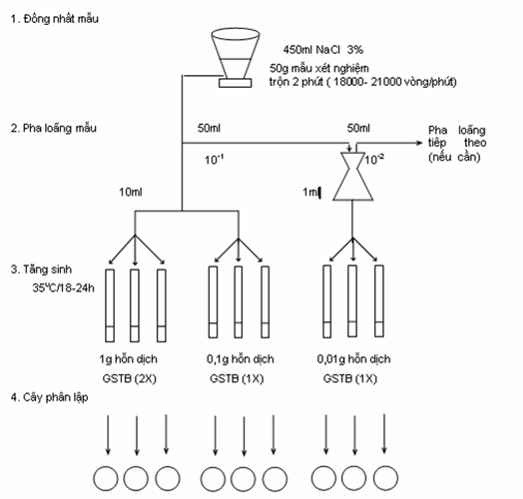
2.2. Chuẩn bị dung dịch mẫu thử 10-1
- Cân chính xác 50 g thực phẩm đã được chuẩn bị (hoặc hút chính xác 50ml thực phẩm lỏng) cho vào bình nón chứa sẵn 450 ml nước đệm muối 3%.
- Lắc đều 2 - 3 phút. Thu được dung dịch mẫu thử 10-1.
2.3. Chuẩn bị dung dịch mẫu thử 10-2,10-3,10 -4...
- Hút chính xác 50ml dung dịch mẫu thử 10-1 cho sang bình nón chứa sẵn 450ml nước đệm muối 3%.
- Lắc đều trong 2 - 3phút. Thu được dung dịch 10-2.
- Tiếp tục làm tương tự như vậy, ta thu được các dung dịch mẫu thử tương ứng 10-3, 10-4, 10-5.... (theo sơ đồ )
3. Phương pháp tiến hành
Bước 1:
- Lấy 10ml dung dịch mẫu thử 10-1 cho sang ống nghiệm chứa sẵn 10 ml canh thang glucoza muối (GSTB) đậm đặc gấp 2 lần và 1ml vào GSTB đậm độ thường. Mỗi đậm độ cấy 3 ống.
- Lấy 1ml dung dịch mẫu thử từ 10-2, 10-3, 10-4 cho sang ống nghiệm chứa sẵn 10ml GSTB đậm độ thường. Mỗi nồng độ pha loãng cấy vào 3 ống. ủ ấm ở 350C/18-24 giờ.
- V. parahaemolyticus hiếu khí tuyệt đối, phát triển tạo thành màng trên bề mặt ống canh thang, chuyển mầu môi trường sang mầu vàng.
Bước 2:
- Lấy canh trùng từ ống canh thang có đậm độ pha loãng thấp nhất vẫn có vi khuẩn phát triển cấy sang các đĩa thạch TCBS. Ria cấy để tạo được các khuẩn lạc riêng rẽ.
- Ủ ở 350C/18 - 24 giờ.
Bước 3:
- Quan sát và nhận định khuẩn lạc trên thạch TCBS.
- V. parahaemolyticus có khuẩn lạc tròn, lồi, bờ đều, đường kính 2 - 3mm trung tâm khuẩn lạc có màu xanh hoặc xanh lá cây.
Bước 4: Tăng sinh thuần chủng và xác định hình thể, tính chất bắt mầu
a) Tăng sinh thuần chủng
- Trích khuẩn lạc điển hình từ thạch TCBS cấy vào môi trường canh thang TSB hoặc canh thang thường có NaCl 3% và ủ ấm 18 - 24 giờ/ 350C, thu được canh trùng thuần nhất.
- Từ canh trùng thuần nhất cấy vào Thạch TSI, TSA nghiêng có NaCl 3%;
ủ ấm 18 - 24 giờ/ 350C.
- Thử nghiệm Oxidaza: Lấy khuẩn lạc trên môi trường TSA làm phản ứng oxidaza trên giấy thử hoặc thuốc thử, oxidaza (+).
b) Hình thể và tính chất bắt mầu
- Từ canh trùng thuần nhất, nhuộm Gram xem hình thể: hình phẩy khuẩn, cong hoặc hình trụ, đầu tròn, không bắt mầu thuốc nhuộm Gram, Gr (-).
- Canh trùng được soi tươi trên lam kính: phẩy khuẩn di động nhanh.
Bước 5: Tính chất sinh vật hoá học
a) Tính chất lên men các loại đường
- Thử tính chất lên men đường glucoza, lactoza, sacaroza, khả năng sinh hơi, sinh H2S trên môi trường TSI.
- Lên men đường sacaroza, manitol, arabinoza.
- Dùng canh thang có chỉ thị màu bromocresol để xác định tính chất lên men các loại đường. Để tủ ấm 350C/ 4 - 5 ngày rồi đọc kết quả.
b) Tính chất ưa muối
- Từ canh trùng thuần nhất cấy vi khuẩn vào ống canh thang muối (STB) có NaCl từ: 0%; 6%; 8%, 10%. ủ ấm ở 350C/24 giờ.
c) Thử nghiệm VP
- Từ canh thang TSB cấy vào canh thang Clark-lubs, ủ ấm ở 350C/48 giờ. Nhỏ thuốc thử 0,2ml KOH 40% và 0,6ml a napton.
- Để ở nhiệt độ thường trong 1 giờ. Đọc kết quả.
d) Test ADH, LDC, ODC
- Dùng que cấy lấy vi khuẩn từ thạch TSA cho vào 3 ống ADH, LDC, ODC (Các ống môi trường đã có parafin vô trùng phủ dày 10mm). Nới lỏng nút bông, để ở nhiệt độ 350C/ 24 giờ, kiểm tra hàng ngày, trong 4 ngày.
- Đọc kết quả: V. parahaemolyticus LDC (+), ADH (-), ODC (+).
e) Test Kanagawa
- Xác định khả năng làm tan máu thỏ dạng b (test phân biệt giữa V.parahaemolyticus phân lập từ thuỷ sản): Cấy vi khuẩn sau khi nuôi cấy 18 giờ lên bề mặt thạch Wagatsuma có máu thỏ thành các chấm. Thử nghiệm phải có chứng dương và chứng âm
- Ủ 350C và đọc kết quả sau 24 giờ.
V. TÍNH KẾT QUẢ
Khuẩn lạc điển hình trên môi trường TCBS tương ứng với nồng độ pha loãng nhất của canh thang GSTB còn có sự phát triển của V.parahaemolysticus. Tra bảng MPN ở nồng độ tương ứng để tính số khuẩn lạc có trong mẫu thử.
Ví dụ:
Nồng độ 10-1: có 3 ống (+);
Nồng độ 10-2: có 1 ống (+);
Nồng độ 10-3: có 0 ống (+)
Tra bảng MPN , xác định trong 1g mẫu thử có 43 con vi khuẩn
Tiêu chuẩn xác định V. parahaemolysticus trong thực phẩm
Phẩy khuẩn, Gr (-) Oxidaza: (+) VP: (-) Di động: (+)
NaCl 0%; (-), NaCl 6%: (+) NaCl 8%: (+) NaCl 10%: (-)
Glucoza (+), Lactoza (+) Sacaroza(-), Hơi (+); H2S: (-)
ADH: (-) ODC: (+) LDC: (+) Kanagawa (-)
Sơ đồ định lượng V. parahaemolyticus
Thạch TCBS
5. Xác định tính chất sinh vật hóa học
6. Tiêu chuẩn xác định V. parahaemolyticus
Phẩy khuẩn, Gr (-) Oxidaza: (+) VP: (-) Di động: (+)
NaCl 0%; (-), NaCl 6%: (+) NaCl 8%: (+) NaCl 10%: (-)
Glucoza (+), Lactoza (+) Sacaroza:(-), Hơi (+); H2S: (-)
ADH: (-) ODC: (+) LDC: (+) Kanagawa (-)
MỘT SỐ MÔI TRƯỜNG CHÍNH ĐỂ XÁC ĐỊNH VÀ ĐỊNH LƯỢNG V. PARAHAEMOLYTICUS
1. Môi trường Glucose Salt Teepol Broth (GSTB)
- Cao thịt bò: 3g
- Pepton: 10g
- NaCl: 30g
- Glucoza: 5g
- Tím methyl: 0,002g
- Teepol: 4ml
- Nước cất: 1lít
* Đối với canh thang đậm đặc thì trọng lượng mỗi thành phần tăng gấp 2 lần
(trừ nước): San ra các ống nghiệm loại 20x150mm, mỗi ống 10ml.
* Đối với canh thang loãng: San ra các ống nghiệm loại 18x150mm, mỗi ống 10ml.
Nếu định lượng mẫu xét nghiệm 25 g, dùng bình có nắp chứa 225 ml canh thang loãng. Hấp ướt 15 phút/1210C, pH = 7,4 ± 0,2.
2. Môi trường thạch đĩa Thiosulfate Citrate Bile Salts Sucrose(TCBS agar)
- Men thủy phân: 5g
- Pepton: 10g
- Sacaroza: 20g
- Natrithiosunfat. 5H2O: 20g
- Natri citrat.2H2O: 10g
- Natri cholat: 3g
- Oxgall: 5g
- NaCl: 10g
- Iron citrat: 1g
- Xanh bromothymol: 0,04g
- Xanh thymol: 0,04g
- Agar: 15g
- Nước cất: 1lít
Đun từ từ cho môi trường chảy. Đun sôi 1 - 2 phút. Không được hấp ướt. San ra các đĩa 20 ml (loại đĩa 15 x 100mm), pH = 8,6.
3. Thạch máu Wagatsuma
- Men thủy phân: 3 g
- Pepton: 10 g
- NaCl: 70 g
- K2HPO4: 5 g
- Mannitol: 10 g
- Tím crystal: 0,01 g
- Agar: 15 g
- Nước cất: 1 lít
Đun từ từ cho tan các chất. Chỉnh pH đến 8,0 ± 0,2. Đun sôi 30 phút (không được hấp ướt). Để nguội xuống còn 500C. Rửa máu người hoặc máu thỏ 3 lần bằng NMSL. Cho máu vào thạch với tỉ lệ 5% máu. Lắc và đổ đĩa. Các đĩa thạch phải được dùng ngay sau khi chuẩn bị.
4. Môi trường HLGB ( Hugh Leifson Glucose Broth)
- Pepton: 2g
- Men thủy phân: 0,5g
- NaCl: 30g
- Dextroza: 10g
- Bromo cresol purpose: 0,015g
- Agar: 3g
- Nước cất: 1lít
* Đun cho các chất hòa tan trong thạch, pH =7,2 ± 0,2.
* Hấp ướt ở 1210C/15 phút.
5. Môi trường canh thang muối trypticase (STB)
- Trypticase: 10g
- Men thủy phân: 3g
- Nước cất: 1 lít
Cho vào mỗi lít môi trường này 0g, 60g, 80g, 100g NaCl để canh thang có nồng độ 0, 6, 8 và 10% NaCl. Hấp ướt 1210C/15 phút, pH =7,5 ± 0,2.
6. Môi trường Trypticase (Tryptic) Soy Agar (TSA)
- Trypticase pepton: 15g
- Phytone pepton: 5g
- NaCl: 5g
- Agar: 15g
- Nước cất: 1 lít
Đun nóng chảy các hóa chất trên. Đun sôi 1 phút. San môi trường ra các ống nghiệm hoặc bình cầu. Hấp ướt 1210C/15 phút, pH=7,3 ± 0,2. Khi dùng để xác định, V. parahaemolyticus phải cho thêm NaCl với nồng độ 25g/l.
7. Canh thang Trypticase Soy Broth (TSB)
- Trypticase pepton: 17g
- Phytone pepton: 3g
- NaCl: 5g
- K2HPO4: 2,5g
- Glucoza: 2,5g
- Nước cất: 1lít
* Chỉnh pH=7,3 ± 0,2
* Đun cho tan hoàn toàn. San 225ml hỗn dịch này vào các bình 500ml. Hấp ướt ở 1210C/15phút. Cho thêm NaCl với nồng độ 25g/l để xác định V. parahaemolyticus.
- 1 Quyết định 2516/QĐ-BKHCN năm 2012 công bố Tiêu chuẩn quốc gia do Bộ trưởng Bộ Khoa học và Công nghệ ban hành
- 2 Quyết định 3005/QĐ-BYT năm 2014 công bố kết quả hệ thống hóa văn bản quy phạm pháp luật về y tế tính đến ngày 31 tháng 12 năm 2013 do Bộ trưởng Bộ Y tế ban hành
- 3 Quyết định 3005/QĐ-BYT năm 2014 công bố kết quả hệ thống hóa văn bản quy phạm pháp luật về y tế tính đến ngày 31 tháng 12 năm 2013 do Bộ trưởng Bộ Y tế ban hành
- 1 Tiêu chuẩn Việt Nam TCVN 8988:2012 về Vi sinh vật trong thực phẩm - Phương pháp định lượng Vibrio parahaemolyticus
- 2 Quyết định 14/1999/QĐ-TTg về việc thành lập Cục Quản lý chất lượng vệ sinh an toàn thực phẩm thuộc Bộ Y tế do Thủ tướng Chính phủ ban hành
- 3 Nghị định 86-CP quy định phân công trách nhiệm quản lý nhà nước về chất lượng hàng hoá

