Water quality - Determination of selected non-polar substances - Method using gas chromatography with mass spectrometric detection (GC-MS)
Lời nói đầu
TCVN 10495:2015 (ISO/TS 28581:2012) hoàn toàn tương đương với ISO/TS 28581:2012.
TCVN 10495:2015 do Tổng cục Môi trường biên soạn, Bộ Tài nguyên và Môi trường đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Các chất không phân cực có mặt trong hầu hết tất cả các loại nước. Các chất này bị hấp phụ lên chất rắn (trầm tích, chất lơ lửng) cũng như hòa tan vào trong pha lỏng.
Phần lớn các chất không phân cực là hydrocacbon thơm đa vòng (PAH). Một số PAH được biết đến hoặc nghi ngờ gây ung thư. Ở một số nước đã thiết lập mức tối đa có thể chấp nhận được. Ví dụ, Nghị định 98/83/EC[10] của hội đồng châu Âu về chất lượng nước dùng cho mục đích sinh hoạt đã thiết lập mức tối đa có thể chấp nhận đối với benzo[a]pyren là 0,010 mg/l, và đối với tổng bốn PAH (benzo[b]florathen, benzo[k]floranthen, benzo[ghi]perylen, indeno[1,2,3-cd]pyren) là 0,100 mg/l.
Có nhiều tiêu chuẩn quốc tế về xác định PAH trong nước và nước thải.
ISO 6468 quy định phương pháp xác định một số hóa chất bảo vệ thực vật clo hữu cơ, PCBs và clorobenzen trong nước uống, nước ngầm, nước mặt và nước thải.
ISO 17933[6] quy định phương pháp xác định 15 PAH bằng sắc ký lỏng hiệu năng cao trong nước uống, nước ngầm và nước mặt.
ISO 7981[2] qui định phương pháp xác định 6 PAH trong nước uống và nước ngầm bằng sắc ký lớp mỏng hiệu năng cao hoặc bằng sắc ký lỏng hiệu năng cao.
ISO 17858[5] quy định phương pháp xác định các PCBs tương tự dioxin trong nước và nước thải.
ISO 28540[9] quy định phương pháp xác định PAH sử dụng sắc ký khí kết hợp khối phổ (GC-MS).
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH MỘT SỐ CHẤT KHÔNG PHÂN CỰC - PHƯƠNG PHÁP SỬ DỤNG SẮC KÝ KHÍ KẾT HỢP KHỐI PHỔ
Water quality - Determination of selected non-polar substances - Method using gas chromatography with mass spectrometric detection (GC-MS)
CẢNH BÁO - Sử dụng tiêu chuẩn này có thể liên quan đến vật liệu, thao tác và thiết bị nguy hại.
Người sử dụng tiêu chuẩn này cần thành thạo với các thực hành trong phòng thí nghiệm thông thường. Tiêu chuẩn này không đề cập tới mọi vấn đề an toàn liên quan đến người sử dụng. Trách nhiệm của người sử dụng là phải xác lập thực hành về an toàn, bảo đảm sức khỏe phù hợp với các quy định của quốc gia.
QUAN TRỌNG - Điều quan trọng là phép thử tiến hành theo tiêu chuẩn này phải được thực hiện bởi các nhân viên đã được đào tạo.
Tiêu chuẩn này quy định phương pháp xác định một số chất không phân cực như hydrocacbon đa vòng và dư lượng hóa chất bảo vệ thực vật bằng sắc ký khí kết hợp khối phổ (GC-MS) trong nước uống và nước ngầm với nồng độ khối lượng lớn hơn 0,005 mg/ trong nước mặt và nước thải với nồng độ khối lượng lớn hơn 0,01 mg/l (đối với từng hợp chất).
Ngoài các hydrocacbon thơm đa vòng (PAH) và dư lượng hóa chất bảo vệ thực vật, phương pháp này có thể áp dụng với các chất không phân cực khác. Tuy nhiên, phải kiểm tra tính phù hợp về khả năng áp dụng của phương pháp với các chất này.
CHÚ THÍCH 1: Phương pháp kiểm chứng phù hợp được quy định trong ISO/TS 13530[3].
Tiêu chuẩn này có thể được dùng cho các mẫu có chứa đến 150 mg/l chất rắn lơ lửng.
CHÚ THÍCH 2: Xác định PAH áp dụng GC-MS thuộc phạm vi của ISO 28540[9].
Các tài liệu viện dẫn sau là cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi (nếu có).
TCVN 6661 -1 (ISO 8466-1), Chất lượng nước -Hiệu chuẩn và đánh giá các phương pháp phân tích và ước lượng các đặc trưng thống kê - Phần 1: Đánh giá thống kê các hàm chuẩn tuyến tính.
TCVN 6663-1 (ISO 5667-1), Chất tượng nước - Lấy mẫu - Phần 1: Hướng dẫn thiết kế chương trình lấy mẫu và kỹ thuật lấy mẫu.
TCVN 6663-3 (ISO 5667-3), Chất lượng nước -Lấy mẫu- Phần 3: Hướng dẫn bảo quản và xử lý mẫu nước.
TCVN 9241 (SO 6468), Chất lượng nước - Xác định thuốc trừ sâu clo hữu cơ nhất định, polyclo biphenyl và clorobezen - Phương pháp sắc ký khí sau khi chiết lỏng-lỏng.
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau:
3.1. Chất phân tích (analyte)
Chất được xác định.
[ISO 15089:2000[4] định nghĩa 3.2].
CHÚ THÍCH 1: Các chất đề cập đến trong tiêu chuẩn này được nêu trong Bảng 1.
3.2. Chuẩn hiệu chuẩn (calibration standard)
Dung dịch được chuẩn bị từ chuẩn thứ và/hoặc dung dịch gốc, được dùng để hiệu chuẩn tín hiệu đáp ứng của thiết bị tương ứng với nồng độ chất phân tích.
[ISO 18073:2004[7] định nghĩa 3.1.2].
3.3. Ion phân tích (diagnostic ion)
Các mảnh ion chọn lọc, ion phân tử hoặc ion đặc trưng khác được chọn lọc từ phổ khối lượng của hợp chất mục tiêu với tính đặc thù cao nhất có thể có.
[ISO 22892:2006[8] định nghĩa 3.6].
3.4. Chuẩn bơm (injection standard)
Hỗn hợp chuẩn được bổ sung vào mẫu trước khi bơm vào thiết bị GC-MS, để giám sát tính biến đổi của tín hiệu trả lời của thiết bị và để tính độ thu hồi nội chuẩn.
3.5. Nội chuẩn (internal standard)
Chuẩn đồng vị đánh dấu hoặc chất không phân cực không có trong mẫu được bổ sung vào mẫu trước khi chiết, được trừ khỏi nồng độ của chất được tính.
CHÚ THÍCH 1: Chất được bổ sung vào mẫu trước khi chiết và được dùng để định lượng các thành phần được đo. Độ thu hồi của các chất chuẩn này được tính toán sử dụng để kiểm tra tính năng của qui trình phân tích.
3.6. Hợp chất nguyên thể/hợp chất nguyên bản (native compound)
Hợp chất không được đánh dấu.
3.7. Cách thức đo ion có chọn lọc (selected ion mode)
SIM
Phương pháp ghi lại ion có chọn lọc (selectec ion recording)
SIR
Đo cường độ chỉ của ion phân tích chọn lọc.
[ISO 22892:2006,[8] định nghĩa 3.8, đã bổ sung, sửa đổi - thêm vào hai tên đồng nghĩa cuối cùng].
Phương pháp quy định trong tiêu chuẩn này có thể xác định các chất không phân cực được liệt kê tại Bảng 1.
Sử dụng phương pháp chiết lỏng-lỏng dùng hexan để chiết các chất không phân cực ra khỏi mẫu nước. Một hỗn hợp nội chuẩn được thêm vào mẫu trước khi chiết. Làm giàu dịch chiết bằng cách làm bay hơi và lượng còn lại được đưa vào dung môi thích hợp để làm sạch hoặc chạy sắc ký khí (GC).
Sử dụng dung môi bay hơi khác nếu chứng minh được có hiệu suất thu hồi bằng hoặc tốt hơn (độ thu hồi từ 70% đến 110%)
CHÚ THÍCH: Dung môi phù hợp khác là: izohexan C6H15 (CAS: 107-83-5);xyclohexan: C6H12 (CAS: 110-82-7); pentan: C5H12 (CAS: 109-66-0); ete dầu mỏ: nhiệt độ sôi từ 40°C đến 60°C.
Phương pháp chiết lỏng-lỏng có thể không sử dụng được với mẫu có hàm lượng chất rắn lơ lửng lớn hơn 150mg/l.
Nếu cần, có thể làm sạch dịch chiết của mẫu nước mặt hoặc nước thải bằng sắc ký cột trước khi phân tích. Trước khi bơm mẫu, chuẩn bơm được thêm vào từng dịch chiết và phần nhỏ dịch chiết được bơm vào sắc ký khí.
Chất không phân cực được tách trên cột mao quản nhồi silica phù hợp, được phủ bằng lớp màng polysiloxan không phân cực hoặc polysiloxan cải biên phân cực nhẹ với quá trình tách hiệu quả. Cột phải phù hợp với việc tách cặp đồng phân của các chất. Nhận biết và định lượng được thực hiện bằng khối phổ (MS) sử dụng bộ ion hóa điện tử (El).
Bảng 1 - Các chất không phân cực có thể xác định bằng qui định kỹ thuật này
| Tên | Công thức phân tử | Khối lượng g/mol | Số CAS | |
| PAH |
| |||
| Naphthalen | C10H8 | 128,17 | 91-20-3 | |
| Acenaphthylen. | C12H8 | 152,20 | 208-96-8 | |
| Acenaphthen | C12H10 | 154,21 | 83-32-9 | |
| Fluoren | C13H10 | 166,22 | 86-73-7 | |
| Phenanthren | C14H10 | 178,23 | 85-01-8 | |
| Anthracen | C14H10 | 178,23 | 120-12-7 | |
| Pyren | C16H10 | 202,26 | 129-00-0 | |
| Fluoranthen | C16H10 | 202,26 | 206-44-0 | |
| Crysen | C18H12 | 228,29 | 218-01-9 | |
| Benzo[a]anthracen | C18H12 | 228,29 | 56-55-3 | |
| Benzo[b]fluoranthen | C20H12 | 252,32 | 205-99-2 | |
| Benzo[k]fluoranthen | C20H12 | 252,32 | 207-08-9 | |
| Benzo[a]pyren | C20H12 | 252,32 | 50-32-8 | |
| Dibenzo[a,h]anthracen | C22H14 | 278,35 | 053-70-3 | |
| Benzo[ghi]perylen | C22H12 | 276,34 | 191-24-2 | |
| Indeno[1,2,3-cd]pyren | C22H12 | 276,34 | 193-39-5 | |
| PCB |
| |||
| PCB-28:2,4,4'-trichlorobiphenyl | C12H7Cl3 | 257,54 | 7012-37-5 | |
| PCB-52:2,2',5,5'-tetrachlorobiphenyl | C12H6Cl4 | 291,99 | 35693-99-3 | |
| PCB-101:2,2',4,5,5'-pentachlorobiphenyl | C12H5Cl5 | 326,43 | 37680-73-2 | |
| PCB-118:2,3',4,4',5-pentachlorobiphenyl | C12H5Cl5 | 326,43 | 31508-00-6 | |
| PCB-138:2,2',3,4,4',5'-hexachlorobiphenyl | C12H4Cl6 | 360,88 | 35065-28-2 | |
| PCB-153:2,2’,4,4',5,5'-hexachlorobiphenyl | C12H4Cl6 | 360,88 | 35065-27-1 | |
| PCB-180: 2,2',3,4,4',5,5'-heptachlorobiphenyl | C12H3Cl7 | 395,33 | 35065-29-3 | |
| OCP |
| |||
| Hexachlorobenzen (HCB) | C6CI6 | 284,78 | 118-74-1 | |
| a-Hexachlorocyclohexan (a-HCH) | C6H6Cl6 | 290,83 | 319-84-6 | |
| b-Hexachlorocyclohexan (b-HCH) | C6H6Cl6 | 290,83 | 319-85-7 | |
| y-Hexachlorocyclohexan (y-HCH) | C6H6Cl6 | 290,83 | 58-89-9 | |
| δ-Hexachlorocyclohexan (δ-HCH) | C6H6Cl6 | 290,83 | 319-86-8 | |
| e-Hexachlorocyclohexan (e-HCH) | C6H6Cl6 | 290,83 | 6108-10-7 | |
| Aldrin | C12H8Cl6 | 364,93 | 309-00-2 | |
| Dieldrin | C12H8Cl6O | 380,91 | 60-57-1 | |
| Endrin | C12H8Cl6O | 380,91 | 72-20-8 | |
| Heptaclor | C10H5Cl7 | 373,32 | 76-44-8 | |
| Heptaclor epoxid (exo-, cis- or b-isomer) | C10H5Cl7O | 389,30 | 28044-83-9 | |
| Heptachlor epoxid (endo-, trans- or a-isomer) | C10H5Cl7O | 389,30 | 1024-57-3 | |
| a-Endosulfan | C9H6Cl6O3S | 406,92 | 959-98-8 | |
| b-Endosulfan | C9H6Cl6O3S | 406,92 | 33213-65-9 | |
| p,p'-DDE | C14H8Cl4 | 318,02 | 72-55-9 | |
| o,p'-DDD | C14H10Cl4 | 320,04 | 53-19-0 | |
| o,p'-DDT | C14H9Cl5 | 354,49 | 784-02-6 | |
| p,p'-DDD | C14H10Cl4 | 320,04 | 72-54-8 | |
| o,p'-DDE | C14H8Cl4 | 318,02 | 3424-82-6 | |
| p,p'-DDT | C14H9Cl5 | 354,49 | 50-29-3 | |
| Methoxychlor | C16H15Cl3O2 | 345,65 | 72-43-5 | |
| Clorobenzens |
|
|
| |
| 1,2,4-Trichlorobenzene | C6H3Cl3 | 181,45 | 120-82-1 | |
| 1,2,3-Trichlorobenzene | C6H3Cl3 | 181,45 | 87-61-6 | |
| 1,3,5-Trichlorobenzene | C6H3Cl3 | 181,45 | 108-70-3 | |
| 1,2,3,4-Tetrachlorobenzene | C6H2Cl4 | 215,89 | 634-66-2 | |
| 1,2,3,5-Tetrachlorobenzene | C6H2Cl4 | 215,89 | 634-90-2 | |
| 1,2,4,5-Tetrachlorobenzene | C6H2Cl4 | 215,89 | 95-94-3 | |
| Pentachlorobenzene | C6HCl5 | 250,34 | 608-93-5 | |
| Pentachloronitrobenzene | C6Cl5NO2 | 295,34 | 82-68-8 | |
| Phospho hữu cơ |
|
|
| |
| Azinphos-ethyl | C12H16N3O3PS2 | 345,40 | 2642-71-9 | |
| Bromofenvinphos-ethyl | C12H14BrCl2O4P | 404,02 | 33399-00-7 | |
| Chlorofenvinphos | C12H14Cl3O4P | 359,57 | 470-90-6 | |
| Chloropyriphos-ethyl | C9H11Cl3NO3PS | 350,59 | 2921-88-2 | |
| Chloropyriphos-methyl | C7H7Cl3NO3PS | 322,53 | 5598-13-0 | |
| Heptenophos | C9H12ClO4P | 250,02 | 23560-59-0 | |
5.1. Cản trở đối với lấy mẫu, chiết và làm giàu
Bình chứa mẫu phải làm bằng vật liệu không gây ảnh hưởng đến chất phân tích trong thời gian tiếp xúc (tốt nhất làm bằng thép không gỉ hoặc thủy tinh). Tránh sử dụng nhựa và các vật liệu hữu cơ khác trừ polytetrafluoroeten (PTFE) trong quá trình lấy mẫu, bảo quản mẫu hoặc chiết. Cần chú ý khi sử dụng các chất hoạt động bề mặt để làm sạch bình chứa mẫu vì chúng có thể tạo thành nhũ tương trong quá trình chiết lỏng-lỏng.
Nếu sử dụng thiết bị lấy mẫu tự động, tránh sử dụng ống làm bằng Silicon hoặc cao su. Nếu sử dụng các vật liệu này, cần giảm thiểu thời gian tiếp xúc. Tráng rửa đường ống lấy mẫu bằng nước trước khi thử mẫu. Xem hướng dẫn trong TCVN 6663-1 (ISO 5667-1) và TCVN 6663-2 (ISO 5667-3).
Tránh để ánh sáng mặt trời chiếu trực tiếp vào mẫu thử và thời gian tiếp xúc với ánh sáng kéo dài. Bảo quản mẫu trong bình chứa mẫu. Có thể sử dụng chai thủy tinh sạch nhưng sau đó mẫu cần phải được giữ trong hộp tối.
Trong quá trình bảo quản mẫu thử, có thể xảy ra việc mất các thành phần do hấp phụ lên thành bình chứa. Mức độ mất phụ thuộc vào thời gian bảo quản.
Làm giàu các dung môi hữu cơ có thể dẫn đến mất các thành phần dễ bay hơi như naphtalen, clorobenzen và hóa chất bảo vệ thực vật có chứa phospho.
5.2. Cản trở với sắc ký khí
Các chất không phân cực tách riêng biệt trên cột mao quản nhồi silica nung chảy, được phủ bằng lớp polysiloxan không phân cực hoặc polysiloxan cải biên phân cực nhẹ với tính năng hiệu quả. Cột cần phải phù hợp với việc tách benzo[a]pyren và benzo[e]pyren. Nhận dạng và định lượng được thực hiện bằng MS sử dụng bộ ion hóa electron (El). Độ phân giải đủ cao (ví dụ không nhỏ hơn R = 0,8) giữa pic benzo[b]fluorathen và benzo[k]fluoranthen cũng như giữa benzo[a]pyren và benzo[e]pyren được đặt làm tiêu chí chất lượng đối với cột mao quản. Benzo[j]fluoranthen có thể không được tách khỏi benzo[k]fluoranthen và benzo[b]fluoranthen. Có thể triphenylen không thể tách hoàn toàn ra khỏi benzo[a]anthracen và chrysen. Nếu hiện tượng này vẫn xảy ra, ghi lại trong báo cáo thử.
CHÚ THÍCH: Benzo[f]fluoranthen, benzo[e]fluoranthen và triphenylen không phải là một phần của 16 chất phân tích PAH.
Có thể khó khăn trong việc tách sắc ký giữa các cặp dưới đây. Do sự khác nhau về khối lượng phân tử của chúng, việc định lượng có thể được thực hiện bằng phát hiện khối lượng chọn lọc. Khi sự phân giải không hoàn toàn, cần phải kiểm tra sự tích hợp các pic và khi cần, hiệu chính lại.
- PCB 52 - PCB 73;
- PCB 101 - PCB 89/PCB 90;
- PCB 118 - PCB 106;
- PCB 138-PCB 164/PCB 163.
Cản trở giữa các các cặp đồng phân của clorobiphenyl cũng có thể quan trọng vì chúng có cùng khối lượng và kiểu phân đoạn. Do vậy, độ phân giải giữa các hợp chất cần phải R > 0,8.
| PCB | Số Ballschmitter |
| - Tricloro | PCB 28-PCB 31 |
| - Tetracloro | PCB 52-PCB 43 |
| - Pentacloro | PCB 101-PCB 113 |
|
| PCB 118-PCB 149 |
| - Hexacloro | PCB 153/PCB 168-PCB 132 |
|
| PCB 138/PCB 164/PCB163-PCB PCB160 |
| - Heptacloro | PCB 180-PCB 193 |
Việc hấp phụ của các thông số chọn lọc, ví dụ 4,4’-DDT (p,p’-DDT); 2.4’-DDT (o,p'-DDT) và/hoặc endrin, có thể xảy ra trong buồng bơm mẫu.
5.3. Cản trở với GC-MS
Các chất cùng được rửa giải với các hợp chất cần phân tích có thể cản trở đến việc xác định. Những cản trở này có thể dẫn đến tín hiệu phân giải không hoàn toàn và phụ thuộc vào độ lớn của chúng có thể ảnh hưởng đến độ chính xác và độ chụm của kết quả phân tích. Những pic không đối xứng rộng hơn pic tương ứng của các chất chuẩn gợi ý đến chất cản trở.
Phân tách sắc ký giữa benzo[a,h]anthracen và indeno[1,2,3-cd]pyren thường khó khăn. Do sự khác nhau về khối lượng phân tử của chúng, việc định lượng có thể được thực hiện bằng phát hiện khối lượng chọn lọc. Khi độ phân giải không hoàn toàn, cần phải kiểm tra sự tích phân các pic và khi cần, hiệu chỉnh lại.
Trong quá trình phân tích, ngoại trừ có chỉ định khác, chỉ sử dụng thuốc thử cấp phân tích được công nhận, “đối với phân tích dư lượng” hoặc “đối với phân tích GC”, tùy từng trường hợp cụ thể, nước cất hoặc nước đã loại khoáng hoặc nước có độ tinh khiết tương đương. Cần chú ý từng mẻ dung môi không được chứa nồng độ trắng ảnh hưởng tới kết quả.
6.1. Chất rắn
6.1.1. Natri sunphat, Na2SO4, khan, làm sạch trước bằng cách nung tới 500 °C trong 4 h hoặc không có hợp chất cản trở.
6.2. Dung môi
6.2.1. Hexan, C6H14.
6.2.2. Axetonitril, CH3CN.
6.2.3. Axeton, C3H6O
6.2.4. Decan, C10H22
6.2.5. lzooctan, C8H18
6.2.6. Diclorometan, CH2Cl2
6.3. Các chất khí
6.3.1. Nitơ, 99,999 % theo thể tích, đồ bay hơi dịch chiết
6.4. Dung dịch chuẩn
6.4.1. Chất chuẩn (xem Bảng 2) và nội chuẩn
Chọn nội chuẩn với đặc tính lý học và hóa học (ví dụ như khả năng chiết, thời gian lưu) tương tự như các đặc tính của các hợp chất cần phân tích.
Sử dụng nội chuẩn đối với từng lớp hợp chất cho phương pháp GC-MS để đánh giá kết quả. Sử dụng ít nhất hai nội chuẩn cho từng loại chất. Kiểm chứng độ ổn định của nội chuẩn thường xuyên. Bảng 2 đưa ra các hợp chất có thể sử dụng. Các nội chuẩn được thêm vào mẫu để chiết và do vậy hòa tan trong dung môi tan trong nước.
CHÚ THÍCH: Có thể sử dụng chuẩn được đánh dấu chất đồng vị 13C làm nội chuẩn.
Các dung dịch đã xác nhận của các chất không phân cực có độ tinh khiết đã xác nhận là có sẵn từ số lượng được giới hạn bởi nhà cung cấp. Vì tính chất nguy hiểm của các chất được sử dụng, tốt nhất là cần có chứng nhận được sử dụng đối với dung dịch chuẩn có bán sẵn. Tránh tiếp xúc với da.
Các nội chuẩn thường được sử dụng nhất là các chất được đánh dấu bằng chất đồng vị. Nên sử dụng các chất này. Chúng được dùng để đánh giá kết quả và định lượng từng chất (Điều 11 và 12).
Bảng 2 - Các chất nội chuẩn đơtơri hóa và chất không phân cực tự nhiên
| Các hợp chất gốc | Nội chuẩn được đánh dấu |
| PAH | PAH |
| Naphthalene | Naphthalene-d8 (CAS No. 1146-65-2) |
| Acenaphthene | Acenaphthene-d10 (CAS No. 15067-26-2) |
| Acenaphthylene | Acenaphthylene-d8 (CAS No. 93951 -97-4) |
| Fluorenee | Fluorenee-d8 (CAS No. 81103-79-9) |
| Anthracene | Anthracene-d8 (CAS No. 1719-06-8) |
| Phenanthrene | Phenanthrene-d8 (CAS No. 1517-22-2) |
| Fluoranthene | Fluoranthene-d8 (CAS No. 93951-69-0) |
| Pyrene | Pyrene-d8 (CAS No. 1718-52-1) |
| Benzo[a]anthracen | Benzo[a]anthracen- d8(CAS No. 1718-53-2) |
| Crysene | Crysene-d8 (CAS No. 1719-03-5) |
| Benzo[b]fluoranthene | Benzo[b]fluoranthene-d8 (CAS No. 93951 -98-5) |
| Benzo[f]fluoranthenea (CAS No. 205-82-3) |
|
| Triphenylenea(CAS No. 217-59-4) |
|
| Benzo[k]fluoranthene | Benzo[k]fluoranthene d12 (CAS No. 93952-01-3) |
| Benzo[a]pyrene | Benzo[a]pyrene d12 (CAS No. 63466-71-7) |
| Benzo[a]pyrene | Benzo[a]pyrenea (CAS No. 192-97-2) |
| Benzo[e]pyrenea (CAS No. 192-97-2) | D12 Available (CIL)b |
| lndeno[1,2,3-cd]pyrene | lndeno[1,2,3-cd]pyrene-d12 (CAS No. 2035781-33-0) |
| Dibenzo[a,h]anthracene | Dibenzo[a,h]anthracene-d14 (CAS No. 13250-98-1) |
| Benzo[ghi]perylene | Benzo[ghi]perylene-d12 (CAS No. 93051-66-7) |
| PCB-28:2,4,4'-trichlorobiphenyl | PCB-28: 13 C-2,4,4'-trichlorobiphenyl |
| PCB-52:2,2',5,5'-tetrachlorobiphenyl | PCB-52:13 C-2,2’,5,5'-tetrachlorobiphenyl |
| PCB-101:2,2’,4,5,5'-pentachlorobiphenyl | PCB-101:13 C-2,2',4,5,5’-pentachlorobiphenyl |
| PCB-118:2,3',4,4’,5-pentachlorobiphenyl | PCB-118:13 C-2,3’,4,4',5-pentachlorobiphenyl |
| PCB-138:2,2’,3,4,4',5-hexachlorobiphenyl | PCB-138:13 C-2,2',3,4,4',5'-hexachlorobiphenyl |
| PCB-153:2,2’,4,4',5,5'-hexachIorobiphenyl | PCB-153:13 C-2,2’,4,4',5,5'-hexachIorobiphenyl |
| PCB-180:2,2',3,4,4',5,5'-heptachlorobiphenyl | PCB-180:13 C-2,2',3,4,4',5,5,-heptachlorobiphenyl |
| OCP | OCP |
| a-Hexachlorocyclohexan (a-HCH) | (a-HCH) 13C6H6Cl6 (CAS No. 222966-66-7) |
| b-Hexachlorocyclohexan (b-HCH) | 13 C Available (CIL)b |
| Y-Hexachlorocyclohexan (y-HCH) | (y-HCH) 13C6H6Cl6 (CAS No. 104215-85-2) |
| δ-Hexachlorocyclohexan (δ-HCH) | 13 C Available (CIL) |
| e-Hexachlorocyclohexan(e-HCH) |
|
| OCP | OCP |
| Aldrin | 13 C Available (CIL)b |
| Dieldrin | 13 C Available (CIL)b |
| Endrin | 13 C Available (CIL)b |
| Heptaclor | 13 C Available (CIL)b |
| Heptaclor epoxid (exo-, cis- or b-isomer) | 13 C Available (CIL)b |
| Heptachlor epoxid (endo-, trans- or a-isomer) |
|
| a-Endosulfan | d4 và 13 C Available (CIL)b |
| b-Endosulfan | d4 và 13 C Available (CIL)b |
| p,p'-DDE | 13 C Available (CIL)b |
| o,p'-DDD | 13 C Available (CIL)b |
| o,p'-DDT | 13 C Available (CIL)b |
| p,p'-DDD | 13 C Available (CIL)b |
| o,p'- DDE | 13 C Available (CIL)b |
| p,p'- DDT | 13 C Available (CIL)b |
| Methoxychlor | 13 C Available (CIL)b |
| 1,2,4-Trichlorobenzene | 13 C Available (CIL)b |
| 1,2,3-Trichlorobenzene | 13 C Available (CIL)b |
| 1,3,5-Trichlorobenzene | 13 C Available (CIL)b |
| 1,2,3,4-Tetrachlorobenzene | 13 C Available (CIL)b |
| 1,2,3,5-Tetrachlorobenzene |
|
| 1,2,4,5-Tetrachlorobenzene | D2 và 13 C Available (CIL)b |
| Pentachlorobenzene | 13 C Available (CIL)b |
| Pentachloronitrobenzene | 13 C Available (CIL)b |
| Hexachlorobenzene (HCB) | 13 C Available (CIL)b |
| Phốt pho hữu cơ | Phốt pho hữu cơ |
| Azinphos-ethyl | 13 C Available (CIL)b |
| Bromofenvinphos-ethyl |
|
| Chlorofenvinphos | 13 C Available (CIL)b |
| Chloropyriphos-ethyl | 13 C Available (CIL)b |
| Chloropyriphos-methyl | 13 C Available (CIL)b |
| Heptenophos |
|
| a Không chất nào trong 16 chất phân tích mục tiêu, nhưng chỉ để kiểm tra dù có đủ độ phân giải. b Phòng thí nghiệm đồng vị Cambridge (CIL) và tiến sỹ Ehrenstorfer là ví dụ về nhà cung cấp phù hợp. Thông tin này được nêu ra để thuận tiện cho người sử dụng tiêu chuẩn này và không xác nhận về nhà cung cấp này. | |
6.4.2. Chuẩn bơm
Thêm chất không phân cực được đánh dấu đồng vị vào dịch chiết cuối cùng và vào dung dịch hiệu chuẩn (6.5.3) trước khi bơm vào GC-MS để kiểm tra độ thu hồi của nội chuẩn.
Chuẩn bị dung dịch gốc của chuẩn bơm trong dung môi phù hợp, ví dụ axetonitril (6.2.2) hoặc hexan (6.2.1) với nồng độ khối lượng, r = 10 mg/ml.
6.5. Dung dịch
6.5.1. Dung dịch gốc đơn chất
Chuẩn bị dung dịch đơn chất nguyên thể và nội chuẩn (xem Bảng 2) trong một dung môi phù hợp, ví dụ axetonitril (6.2.2) hoặc hexan (6.2.1), với nồng độ khối lượng r = 200 mg/ml.
Các dung dịch này có thể được dùng để xác nhận và nhận biết các thành phần đơn lẻ trong sắc đồ.
6.5.2. Dung dịch gốc nhiều chất
Pha loãng một thể tích vừa đủ, ví dụ 5 ml dung dịch gốc đơn chất (6.5.1) vào bình định mức (ví dụ 100 ml) với một dung môi thích hợp, ví dụ axetonitril (6.2.2) hoặc hexan (6.2.1) để chuẩn bị dung dịch có nồng độ khối lượng, r = 10 mg/ml.
Cách khác, có thể sử dụng dung dịch hỗn hợp/Kết hợp có bán sẵn (đã được chứng nhận) một hoặc vài chất chuẩn (xem Bảng 2) ở nồng độ khối lượng phù hợp với từng chất tương ứng. Ví dụ 10 mg/ml trong dung môi phù hợp, axetonitril (6.2.2) hoặc hexan (6.2.1).
Dung dịch 6.4.2, 6.5.1 và 6.5.2 bền trong một năm khi được bảo quản trong chỗ tối ở nhiệt độ phòng và tránh để bay hơi. Độ bền của dung dịch tiêu chuẩn cần phải được kiểm tra thường xuyên. Với mục đích này, cần phải có sẵn dung dịch độc lập để kiểm soát chất lượng trong phòng thí nghiệm.
6.5.3. Dung dịch hiệu chuẩn (CS)
Chuẩn bị ít nhất năm dung dịch hiệu chuẩn (CS1 đến CS5) bằng cách pha loãng phù hợp với dung dịch gốc nhiều chất (6.5.2), dùng hexan (6.2.1) hoặc axetonitril (6.2.2) làm dung môi. Thêm vào mỗi dung dịch cùng một lượng dung dịch gốc của chuẩn bơm để có nồng độ cuối cùng, r = 100 ng/ml.
Dung môi dùng cho dung dịch hiệu chuẩn nên giống với dung dịch chiết cuối cùng.
Chuyển, ví dụ 50 ml dung dịch gốc nhiều chất vào bình định mức 5 ml và làm đầy đến vạch mức bằng dung môi phù hợp. Thể tích của 1 ml dung dịch chuẩn này chứa 100 pg mỗi chất cần phân tích (r = 100 ng/ml).
Nồng độ khối lượng của chất không phân cực trong dung dịch gốc nhiều chất cần phải kiểm tra bằng cách so sánh với dung dịch chuẩn độc lập, ưu tiên dung dịch chuẩn đã được chứng nhận. Tất cả các chất đơn lẻ phải nằm trong khoảng sai số ± 10 % so với chuẩn độc lập.
Dung dịch chuẩn này phải được dùng để hiệu chuẩn hệ thống GC [hỗn hợp trong hexan (6.2.1) cũng như để kiểm tra tỉ lệ thu hồi [hỗn hợp trong axeton (6.2.3)].
Bảo quản dung dịch ở (3 ± 2) °C trong tối. Các dung dịch này bền trong 1 tháng.
7.1. Yêu cầu chung
Bình thủy tinh tiêu chuẩn và thanh khuấy được làm sạch để loại bỏ hết tất cả các chất cản trở.
CHÚ THÍCH: Tất cả bình thủy tinh và thanh khuấy có thể được làm sạch, ví dụ bằng cách tráng rửa với nước tẩy, nước nóng và sấy trong khoảng từ 15 min đến 30 min ở 120 °C. Sau khi làm nguội, bình thủy tinh có thể được tráng bằng axeton và được bảo quản kín trong môi trường sạch.
Không sử dụng lại bình thủy tinh và thanh khuấy đã tiếp xúc với mẫu nước - nước thải hoặc mẫu có nồng độ cao đối với phân tích nước uống. Đặc biệt khi phân tích PAH, PCB và HCH.
7.2. Chai thủy tinh màu, cổ hẹp, đáy bằng, 1000 ml có nắp lót nhôm.
7.3. Khuấy từ, có thanh khuấy (cỡ khoảng 2 cm) bằng thủy tinh hoặc bọc PTFE, giữ trong dung môi được dùng để chiết.
7.4. Phễu tách, dung tích danh định 1000 ml, có Khóa PTTE và nắp thủy tinh.
7.5. Bình nón, dung tích danh định 250 ml, có nắp thủy tinh.
7.6. Thiết bị để làm giàu dung dịch rửa giải bằng bay hơi, ví dụ máy làm bay hơi quay, có thể điều chỉnh để cho chân không không đổi và kèm bể kiểm soát nhiệt độ bằng nước, hoặc thiết bị làm khô sử dụng khí nitơ.
7.7. Thiết bị chân không để chiết pha rắn, ví dụ hộp chân không, hộp chiết.
7.8. Xyranh microlit, ví dụ 500 ml và 1000 ml.
7.9. Bình khử, 100 ml (ví dụ như Hình B.3).
7.10. Máy ly tâm có trục quay, kèm ống ly tâm (ví dụ như Hình B.2) với đáy nhỏ dần, 50 ml.
7.11. Bộ rung, có thể điều chỉnh tốc độ quay.
7.12. Lọ thủy tinh, của máy lấy mẫu tự động, dung tích, ví dụ 2 ml, có nắp làm bằng vật liệu trơ và lớp bọc bằng PTFE.
7.13. Lọ thủy tinh, ví dụ ống của máy ly tâm, có vạch chia độ (có vạch chia 0,1 ml), dung tích danh định 10 ml, có nắp bằng thủy tinh.
7.14. Sắc ký khí, kết hợp với detector MS (El).
7.15. Cột mao quản, phân giải cao dùng cho GC (xem Phụ lục A).
7.16. Màng vi lọc, màng ưa nước chịu dung môi, cỡ lỗ 0,45 mm.
7.17. Pipet Pasteur.
7.18. Cột thủy tinh, nhồi đầy với ít nhất 0,5 g silica (xem 7.19).
CHÚ THÍCH: Các cột này có bán sẵn trên thị trường.
7.19. Silica, cỡ hạt trung bình Khoảng 40 mm, nung nóng ở 450 °C trong 3 h và bảo quản trong bình hút ẩm để đảm bảo hoạt tính tối đa.
CHÚ THÍCH: Cartric silica được nhồi trước có bán sẵn trên thị trường.
7.20. Rây phân tử, đường kính lỗ 0,4 nm.
7.21. Bông thủy tinh
Lấy mẫu vào chai thủy tinh màu dung tích 1000 ml (7.2).
Khi lấy mẫu nước uống từ vòi của hệ thống cung cấp nước, lấy mẫu trước khi khử trùng vòi bằng ngọn lửa đối với lấy mẫu vi khuẩn.
Nạp đầy chai tới vai của chai (khoảng 950 ml). Xác định thể tích mẫu được chiết bằng cách xác định khối lượng, trước khi chiết và sau khi chai rỗng, với độ chính xác ± 5 g. Bảo quản mẫu ở (3 ±2) °C và tránh ánh sáng trực tiếp tới khi tiến hành chiết (xem TCVN 6663-3 (ISO 5667-3)).
Đảm bảo rằng việc chiết được thực hiện trong khoảng thời gian bảo quản tối đa, như quy định trong TCVN 6663-3 (ISO 5667-3) để tránh mất các chất.
Nói chung, nên tiến hành chiết càng sớm càng tốt để giảm thiểu những tác hại tiềm tàng của bình chứa mẫu có thể xảy ra.
9.1. Yêu cầu chung
Phương pháp chiết lỏng-lỏng không được sử dụng với mẫu chứa chất lơ lửng lớn hơn 150 mg/l.
CHÚ THÍCH: Ngoài hexan, dung môi bay hơi có thể được dùng nếu chứng minh được các dung môi này có độ thu hồi bằng hoặc tốt hơn (độ thu hồi từ 70% đến 110%).
9.2. Chiết mẫu
9.2.1. Chuẩn bị mẫu và chiết
Thêm lượng chính xác đã định chất nội chuẩn (ví dụ thể tích chứa 50 ng) hòa tan trong mẫu nước (6.4.2). Thêm 25 ml hexan (6.2.1) và thanh khuấy, sau đó đóng bình có nắp vòng PTFE hoặc đậy bình nón (7.5) với nút nhám. Lắc kỹ mẫu bằng khuấy từ (7.3) trong khoảng tối đa 60 min. Chuyển mẫu vào phễu tách và để tách pha trong ít nhất 5 min. Nếu tạo thành nhũ tương trong quá trình chiết, thu lấy nhũ tương này vào ống ly tâm và ly tâm (7.10), ví dụ trong 10 min ở tốc độ khoảng 3000 r/min. Chuyển nước đã tách bằng pipet Pasteur. Chuyển dịch chiết vào bình nón (7.5) và làm khô theo 9.2.2.
Đối với nước thải và nước mặt, lặp lại quy trình chiết hai lần. Chuyển mẫu từ phễu tách vào lại bình chứa mẫu, thêm 25 ml hexan (6.2.1), và tiến hành như mô tả ở trên.
Quy trình chiết cũng có thể được tiến hành trong một phễu tách (7.4) sử dụng thiết bị lắc (7.11) và bộ vi tách (xem Phụ lục B). Tráng chai kỹ bằng dung môi chiết để chiết hết các thành phần đã hấp phụ.
CHÚ THÍCH 1: Dung môi bay hơi khác cũng có thể được dùng nếu chứng minh hiệu suất thu hồi bằng hoặc tốt hơn (độ thu hồi từ 70% đến 110 %).
CHÚ THÍCH 2: Đối với chiết nước thải và mẫu nước khác nghi ngờ nồng độ PAH cao, có thể chỉ chuyển 10 ml đến 100 ml mẫu đồng nhất vào bình nón 250 ml (7.5) bằng pipet và pha loãng bằng nước tới 200 ml. Sau Khi thêm 25 ml hexan (6.2.1), tiến hành quy trình như mô tả ở trên.
9.2.2. Làm khô dịch chiết
Chuyển lớp hexan thu được theo 9.2.1 vào bình nón 100 ml. Tráng phễu hoặc ống ly tâm bằng 5 ml hexan và gộp chúng vào dịch chiết.
Làm khô dịch chiết với khoảng 1,0 g natri sunphat (6.1.1) trong ít nhất 15 min, xoay bình thường xuyên. Dịch chiết có thể được làm khô bằng cách lọc qua natri sunphat khan.
Gạn dịch chiết sấy vào bình khử (7.9). Tráng bình nón hai lần bằng 5 ml hexan và gạn vào bình khử.
9.2.3. Làm giàu
Làm bay hơi dịch chiết hexan khô thu được theo 9.2.2 cho tới khi nó chỉ còn ở đầu nhọn của bình khử (khoảng 2 ml), ví dụ, dùng máy cô quay, tại nhiệt độ 30 °C, giảm áp suất từ từ xuống 20 kPa.
Không làm bay hơi dịch chiết tới khô kiệt, vì có thể làm mất ví dụ, hợp chất 2 hoặc 3 vòng và 1,2,4-triclorobenzen. Thêm vài giọt decan (6.2.4) hoặc izooctan (6.2.5) để hạn chế việc mất phần lớn các chất hữu cơ bay hơi.
Hòa tan dịch chiết vào một thể tích đã biết, ví dụ 2 ml. Đảm bảo rằng cặn có thể được lắng đọng lên trên thành bình đều được hòa tan bằng cách lắc dịch chiết sử dụng thiết bị lắc.
Làm sạch dịch chiết mẫu nước thải và mẫu khác chưa biết nguồn gốc bằng silica theo 9.2.4, nếu sắc đồ cho thấy có chất cản trở đến việc định lượng.
Chuyển mẫu đã làm giàu vào lọ đựng mẫu bằng thủy tinh, nếu cần sau khi lọc qua màng lọc (7.16). Lưu giữ mẫu ở nơi mát, tối cho đến khi thực hiện phân tích.
Tiến hành quy trình như mô tả ở 9.4.
CHÚ THÍCH: Có thể sử dụng phương pháp làm giàu khác. Nếu dùng bơm mẫu có thể tích lớn hoặc nếu dự đoán nồng độ của hợp chất cần phân tích cao hơn, có thể sử dụng hệ số làm giàu thấp hơn.
9.2.4. Làm sạch
Áp dụng quy trình như mô tả ở 9.2 có thể dẫn đến việc cùng chiết các chất phân cực có liên quan và/hoặc các chất khác không mong muốn, điều này có thể gây khó khăn do xuất hiện các pic chưa biết, chồng lên các pic của các chất cần phân tích. Khi chất cần phân tích là PAH, quy trình làm sạch bằng silica được mô tả trong Phụ lục C có thể được dùng. Sử dụng quy trình làm sạch đối với các chất không phân cực khác được quy định trong TCVN 9241 (ISO 6468).
9.3. Sắc ký khí
Vận hành máy sắc ký khí theo hướng dẫn của nhà sản xuất.
Lựa chọn cột mao quản và điều kiện sắc ký để việc tách hiệu quả (xem Phụ lục A)).
Khi sử dụng chuẩn bơm, thêm chính xác một lượng đã biết chuẩn bơm (6.4.2) vào mẫu chiết, lắc kỹ và bơm ngay vào GC.
9.4.Đo mẫu trắng
Phải phân tích để xác định mẫu trắng ít nhất một lần cho mỗi mẻ nước trước khi tiến hành và trong quá trình thực hiện một loạt phân tích. Loại nước này phải không có hợp chất cần xác định ở mức có thể phát hiện được. Đo mẫu trắng phải bao gồm tất cả các bước của quy trình phân tích từ khi nhận mẫu ở phòng thí nghiệm đến khi đánh giá sắc đồ khí. Nếu giá trị trắng cao bất thường (trên 50 % mức báo cáo thấp nhất), cần phải kiểm tra lại từng bước trong quy trình để tìm được lý do dẫn đến những mẫu trắng cao bất thường này. Đảm bảo rằng giá trị mẫu trắng được giảm tới mức tối thiểu bằng các quy trình khác nhau, ví dụ loại bỏ các chất ô nhiễm của mẫu từ không khí xung quanh và dung môi, đồng thời kiểm tra thiết bị phân tích.
Nếu nồng độ mẫu gần bằng với giới hạn phát hiện, nhưng, giá trị mẫu trắng cao hơn 50 % so với giá trị báo cáo thấp nhất thì cũng có thể chấp nhận. Nếu xảy ra trường hợp này, mẫu nên được cô đặc và thử lại để xác nhận.
9.5. Điều kiện khối phổ
Điều chỉnh khối phổ theo hướng dẫn của nhà sản xuất. Sắc ký được ghi lại trong phổ quét đầy đủ (50 amu đến 420 amu) hoặc chế độ quan trắc/ghi ion lựa chọn (SIM/SIR).
Điều chỉnh tốc độ quét của máy quang phổ khối lượng ở vận tốc cho phép sao cho một pic GC được mô tả bằng ít nhất bảy điểm số liệu.
Các ion chuẩn đoán với cường độ tương ứng theo ISO 22892[8] được nêu trong Bảng 4.
CHÚ THÍCH: Tỷ số tương quan được xác định theo quy trình mô tả bằng cách sử dụng nội chuẩn đã được đơterri hóa như được đề cập ở trên.
10.1. Khái quát
Đường chuẩn được xây dựng cho mỗi hợp chất dựa trên một dải nồng độ. Tỷ số tương quan [Rrel hoặc FR tùy thuộc vào sử dụng nội chuẩn được đánh dấu hay chuẩn nguyên khác (không được đánh dấu)] ứng với mỗi nồng độ trong dung dịch chuẩn được lập đường chuẩn hoặc tính trên máy tính sử dụng hàm hồi quy. Tỷ số tương quan được xác định theo quy trình được mô tả dưới đây. Thực hiện ít nhất năm điểm hiệu chuẩn. Xem thêm TCVN 6661-1 (ISO 8466-1).
10.2. Hiệu chuẩn bằng nội chuẩn đánh dấu
Sử dụng hiệu chuẩn bằng nội chuẩn đánh dấu cho các chất không phân cực bằng cách bổ sung các hợp chất được đánh dấu vào mẫu.
Chuẩn bị đường chuẩn gồm một dải nồng độ đối với từng hợp chất được xác định. Lập đường chuẩn dựa trên tỷ số tương quan, Rrel (giữa hợp chất đánh dấu và hợp chất gốc) với nồng độ trong các dung dịch chuẩn hoặc tính bằng máy tính sử dụng hồi quy tuyến tính. Xác định tỷ số tương quan đối với từng chất không phân cực theo quy trình mô tả dưới đây. Thực hiện ít nhất năm điểm hiệu chuẩn.
Xác định tỷ số tương quan của từng chất không phân cực tương ứng với chất tương tự được đánh dấu sử dụng Công thức (1):
|
| A1nrL | (1) |
| A1Lrn |
Trong đó:
A1n là diện tích của pic ion chẩn đoán 1 đối với chất không phân cực;
A1L là diện tích của pic ion chẩn đoán 1 đối với hợp chất đánh dấu;
rL là nồng độ của hợp chất đánh dấu trong dung dịch chuẩn hiệu chuẩn, tính bằng microgam trên lít;
rn là nồng độ của hợp chất gốc (không phân cực) trong dung dịch chuẩn hiệu chuẩn, tính bằng microgam trên lít.
CHÚ THÍCH 1: Tỷ số tương quan đối với mọi hợp chất là không đổi (hệ số biến thiên nhỏ hơn 20 %) trong cả 5 điểm chuẩn, thì có thể sử dụng tỷ số trung bình cho hợp chất đó. Ngược lại, sử dụng đường chuẩn 5 điểm đối với hợp chất đó.
CHÚ THÍCH 2: Cũng có thể chỉ sử dụng khối lượng để hiệu chuẩn và định lượng.
10.3. Hiệu chuẩn bằng nội chuẩn
Phương pháp nội chuẩn được áp dụng để xác định các chất không phân cực khác mà chất chuẩn không đánh dấu phải được thêm vào mẫu.
Hiệu chuẩn yêu cầu xác định tỷ số đáp ứng, FR, được xác định bằng Công thức (2):
| FR= | A1sris | (2) |
| A1isrs |
Trong đó:
A1s là diện tích của pic ion chẩn đoán 1 đối với chất không phân cực;
A1is là diện tích của pic ion chẩn đoán 1 đối với chất nội chuẩn;
ris là nồng độ của chất nội chuẩn, tính bằng microgam trên lít;
rs là nồng độ của hợp chất trong chất chuẩn hiệu chuẩn, tính bằng microgam trên lít.
CHÚ THÍCH: Tỷ số đáp ứng FR đối với mọi hợp chất là không đổi (hệ số biến thiên nhỏ hơn 20 %) trên khoảng hiệu chuẩn 5 điểm, thì có thể sử dụng tỷ số trung bình cho hợp chất đó. Ngược lại, đường chuẩn 5 điểm hoàn chỉnh được sử dụng cho hợp chất đó.
Đối với việc kiểm tra hiệu chuẩn hàng ngày (hiệu chuẩn lại), bơm ít nhất hai dung dịch hiệu chuẩn, ví dụ nồng độ (20 ±10) % và (80 ± 10) % của khoảng tuyến tính đã được thiết lập. So sánh tỷ số đáp ứng đã tính được với hệ số thu được trong mẻ mẫu trước. Các giá trị này không được sai khác quá 20 %.
Cân chỉnh hệ thống đo trước khi đo mẫu và điều chỉnh máy phổ khối lượng theo hướng dẫn của nhà sản xuất.
Áp dụng các điều kiện đo sau đây.
| Phương pháp ion hóa: | va chạm electron |
| Dải khối lượng của phổ: | 50 amu đến 420 amu, ít nhất lớn hơn 10 amu khối lượng lớn nhất của chất cần xác định. |
| Quãng chu kỳ: | Khoảng thời gian xoay vòng < 2s sao cho năm phổ có thể được thực hiện trên pic của chất. |
Nếu chỉ các khối lượng đơn được ghi nhận để làm tăng độ nhạy, cần ghi lại pic nền và ít nhất hai ion nữa với cùng quãng chu kỳ như ở trên.
Định lượng một chất đơn đòi hỏi việc nhận dạng phải chắc chắn và rõ ràng. Các thành phần có ít mảnh vỡ cần phải có tiêu chí bổ sung để nhận dạng.
Khi lấy toàn bộ phổ, phổ mẫu đo và phổ chuẩn được tạo ra trong cùng điều kiện làm việc, phải được nhận dạng. Phổ chuẩn phải được mỗi phòng thí nghiệm sử dụng thiết bị của mình tạo ra và phải được lưu giữ trong cơ sở dữ liệu phổ chuẩn. Các phổ này có thể được dùng cho các mục đích nhận dạng bằng MS.
Độ lệch của pic không phải pic nền (không phải pic 100 % khối lượng) phải nhỏ hơn 10 %.
Nếu có độ lệch thời gian lưu, khẳng định việc nhận dạng có thể thực hiện bằng cách thêm chuẩn. Sử dụng chuẩn được đánh dấu chất đồng vị là cách tốt nhất để khẳng định sự nhận dạng.
Một chất đơn được nhận biết, nếu:
- Thời gian lưu của một chất trong sắc đồ ion của tổng dòng ion của mẫu đồng dạng với sắc đồ của tổng ion của một chất chuẩn đối chiếu trong dung dịch chuẩn thu được cuối cùng, được thực hiện với điều kiện sắc ký như nhau (giới hạn: ± 1 %; tối đa ± 6 s);
- Cường độ tương đối của ion chẩn đoán ghi được trong phổ khối lượng của mẫu thu được dưới điều kiện như nhau không sai khác quá ± (0,1I +10) % so với cường độ tương đối của chất chuẩn, trong đó I là cường độ tương đối ghi được từ ion đặc trưng trong phổ khối lượng của dung dịch chuẩn.
Xem Bảng 3.
Bảng 3 - Mức độ khẳng định của nhận dạng
| Kỹ thuật | Mức độ nhận dạng | Nguyên tắc vận hành | Tiêu chí bổ sung |
| MS | Có thể | Quan trắc khối lượng đơn (SIM/SIR) | Tuân theo tỉ số khối lượng với hợp chất tiêu chuẩn trong giới hạn đã cho |
|
| Khẳng định | Thu phổ tổng (quét) | Sự Phù hợp của phổ với hợp chất tiêu chuẩn trong giới hạn đã cho |
Cập pic tới hạn có thể dẫn đến sự phân bố tự động sai. Trong những trường hợp như vậy, việc kiểm tra thủ công là cần thiết. Cặp pic tới hạn là: phenanthren và anthracen; benzo[a]anthracen và chrysen; benzo[b]floranthen và benzo[k]floranthen; benzo[a]pyren và benzo[e]pyren; PCB28 và PCB31.
Các hợp chất chồng lấn pic có khối lượng tương tự nhau có thể được phân định nếu giá trị chồng lấn giữa hai pic tối thiểu ít hơn 25 % tính từ pic nền, nếu không chúng được báo cáo là tổng.
Khi sử dụng khối lượng đơn, tất cả ba tín hiệu khối lượng cần phải có. Tỉ số tín hiệu so với nhiễu đối với pic nhỏ nhất của một khối lượng phải lớn hơn 3.
Tỉ số của ba khối lượng trong phổ phải được xác định từ chiều cao pic tại pic tối đa. Hai pic tương ứng với các khối lượng dưới 100 % được xác định. Pic tương ứng với 100 % khối lượng phải có sai số nằm trong khoảng 10 % giá trị pic đã xác định trong cùng điều kiện của chất chuẩn.
Phổ khối lượng của mẫu phải bao gồm tất cả các ion có cường độ tương ứng có sai số dưới 10 % so với phổ chuẩn. Tỉ số cường độ của ion khác nhau trong phổ mẫu và phổ chuẩn phải nằm trong vòng 20 %, khi thử trên ba ion quan trọng nhất.
Việc ghi nhận khối lượng đơn phải được ghi trong báo cáo thử nghiệm.
Đối với việc phát hiện bằng MS, sử dụng diện tích pic của pic nền của chất i, sau khi kiểm tra nhận dạng bằng so sánh phổ, hoặc với kỹ thuật SIM, sử dụng các tỷ số đồng vị hoặc phân đoạn. Nếu sử dụng chất nội chuẩn, tín hiệu của khối lượng có cường độ lớn nhất (ion chính) luôn dùng để đối chiếu, sau khi tín hiệu này được kiểm tra về độ tinh khiết.
Bảng 4 - Các khối lượng đặc trưng được khuyến nghị của các chất không phân cực, như quy định trong ISO 22892[8]
| Hợp chất | lon chẩn đoán 1a m/z | lon chẩn đoán 2a m/z | lon chẩn đoán 3a m/z |
| PAH |
| ||
| Naphthalen | 128 (100) | 102 (11) | - |
| Acenaphthylen | 152(100) | 150 (3) | 76(10) |
| Acenaphthen | 153 (100) | 154 (70) | 76(10) |
| Fluoren | 155(150) | 166 (81) | 139 (4) |
| Phenanthren | 178(100) | 152 (9) | 76b (3) |
| Anthracen | 178 (100) | 152 (12) | 76 (6) |
| Fluoranthen | 202 (100) | 200 (31) | 100b (3) |
| Pyren | 202 (100) | 200 (2) | 101b (4) |
| Benzo[a]anthracen | 228 (100) | 226 (3) | 114b (2) |
| Chrysen | 228 (100) | 226 (6) | 113b (4) |
| Benzo[b]fluoranthen | 252 (100) | 250 (22) | 126 (5) |
| Benzo[k]fluoranthen | 252(100) | 250 (22) | 126 (5) |
| Benzo[a]pyren | 252 (100) | 250 (18) | 113 (11) |
| lndeno[1,2,3-cd]pyren | 276 (100) | 138 (12) | 274b * (4) |
| Dibenzo[a,h]anthracen | 278 (100) | 139 (9) | 276b * (5) |
| Benzo[ghi]perylene | 276 (100) | 138 (12) | 274 (4) |
| PCB |
|
|
|
| PCB 28 | 186 (100) | 258 (74) | 186 (82) |
| 13C12-PC8 28 | 268 | 270 | — |
| PCB 52 | 292 (100) | 294 (49) | 220 (95) |
| 13C12-PCB 52 | 304 | 306 | — |
| PCB101 | 326 (100) | 328 (65) | 256 (62) |
| 13C12-PCB101 | 338 | 340 | — |
| PCB 118 | 326 (100) | 328 (62) | 254 (57) |
| 13C12-PCB 118 | 338 | 340 |
|
| PCB 138 | 290 (100) | 358 (42) | 360 (94) |
| 13C12-PCB 138 | 372 | 374 | — |
| PCB153 | 360 (100) | 362 (92) | 290 (73) |
| 13C12-PCB 153 | 372 | 374 | — |
| PCB 180 | 394 (100) | 396 (96) | 324 (84) |
| 13C12-PCB 180 | 406 | 408 | — |
Bảng 4 - (Kết thúc)
| Hợp chất | lon chẩn đoán 1a | lon chẩn đoán 2a | lon chẩn đoán 3a |
| OCP |
| ||
| Hexachlorobenzene (HCB) | 284 (100) | 142 (22) | 249 (24) |
| a-Hexachlorocyclohexane (a-HCH) | 181 (100) | 219 (33) | 109 (29) |
| b-Hexachlorocyclohexane (b-HCH) | 181 (97) | 219 (54) | 109 (49) |
| y-Hexachlorocyclohexane (y-HCH) | 181 (97) | 219 (34) | 109 (33) |
| δ-Hexachlorocyclohexane | 109 (100) | 219 (96) | 183 (90) |
| e-Hexachlorocyclohexane | 109 (88) | 219 (100) | 183 (90) |
| Aldrin | 66(100) | 263 (78) | 293 (41) |
| Dieldrin | 79 (100) | 263 (70) | 277 (18) |
| Endrin | 81 (100) | 263 (70) | 277 (18) |
| Heptachlor | 100 (100) | 65 (65) | 272 (89) |
| Heptachlor epoxide (cis-isomer) | 253 (100) | 183 (90) | 289 (85) |
| Heptachlor epoxide (trans-isomer) | 353 (100) | 81 (67) | 263 (26) |
| a-Endosulfan | 195 (100) | 159 (93) | 265 (55) |
| b-Endosulfan | 195 (100) | 241 (80) | 159 (56) |
| p,p'-DDE | 246 (100) | 318 (37) | 176 (36) |
| o,p'-DDD | 235 (102) | 165(66) | 199 (29) |
| o,p'- DDT | 235 (100) | 165 (67) | 199 (27) |
| p,p'-DDD | 235 (100) | 165 (66) | 199(20) |
| o,p'-DDE | 246 (100) | 318 (37) | 176 (27) |
| p,p'- DDT | 235 (100) | 165 (68) | 199 (20) |
| Methoxychlor | 227 (100) | 228 (18) | 274 (5) |
| Clorobenzen |
|
|
|
| 1,2,4-Trichlorobenzene | 180 (100) | 182 (97) | 145 (45) |
| 1,2,3-Trichlorobenzene | 180 (100) | 182 (92) | 145 (38) |
| 1,3,5-Trichlorobenzene | 180 (100) | 182 (95) | 145 (32) |
| 1,2,3,4-Tetrachlorobenzene | 216 (100) | 214 (74) | 108 (24) |
| 1,2,3,5-Tetrachlorobenzene | 216 (100) | 214 (78) | 108 (14) |
| 1,2,4,5-Tetrachlorobenzene | 216 (100) | 214 (79) | 108 (12) |
| Pentachlorobenzene | 250 (100) | 252 (63) | 215 (25) |
| Pentachloronitrobenzene | 237 (100) | 295 (83) | 142 (50) |
| Phospho hữu cơ |
|
|
|
| Azinphos-ethyl | 132 (100) | 160 (80) | 77 (68) |
| Bromofenvinphos | 267 | 269 | 323 |
| Chlorofenvinphos | 267 (100) | 323 (59) | 81 (58) |
| Chloropyriphos-ethyl | 97 (100) | 197 (90) | 314 (47) |
| Chloropyriphos-methyl | 286 (100) | 125 (95) | 288 (78) |
| Heptenophos | 124 (100) | 89 (77) | 215 (13) |
| a Trong ngoặc: mật độ tương đối của ion mảnh. b Thường mất mảnh | |||
13.1. Định lượng bằng nội chuẩn
Để tính toán nồng độ của các chất không phân cực dùng phương pháp nội chuẩn sử dụng tỷ số đáp ứng được xác định từ số liệu hiệu chuẩn ban đầu (10.3) và Công thức (3):
|
| A1smis | (3) |
| A1isFR |
Trong đó:
mex là lượng chất không phân cực trong dịch chiết, tính bằng nanogam;
A1s là diện tích ion chẩn đoán 1 đối với chất không phân cực;
mis là lượng nội chuẩn, tính bằng nanogam;
A1is là diện tích của ion chẩn đoán 1 đối với nội chuẩn;
FR là tỷ số đáp ứng như được xác định trong 10.3.
Xác định tỷ số đáp ứng của nội chuẩn tương ứng với chuẩn bơm bằng cách sử dụng diện tích pic của ion chẩn đoán. Sử dụng nồng độ chất trong dịch chiết được xác định bằng Công thức (3), để tính phần trăm thu hồi, n, của nội chuẩn theo công thức (4):
|
| mex | x 100 (4) |
| mspk |
Trong đó:
mex là lượng chất tìm thấy trong dung dịch, tính bằng nanogam;
mspk là lượng chất chuẩn thêm vào dung dịch, tính bằng nanogam.
Đối với hợp chất, khi xác định không thêm nội chuẩn, hiệu suất thu hồi được xác định như sau:
Ví dụ, thêm 2 ml dung dịch chuẩn được chuẩn bị theo 6.4.1 vào 1000 ml nước và tiến hành như quy định trong Điều 9.
Xác định tỉ lệ thu hồi đối với mẫu nước mặt bằng phương pháp thêm chuẩn.
Xác định độ thu hồi trung bình, ![]() , của chất phân tích i sử dụng Công thức (5) và (6):
, của chất phân tích i sử dụng Công thức (5) và (6):
|
| ri.Nf | (5) |
| ri.Ne | ||
|
|
| (6) |
| n |
Trong đó:
![]() là độ thu hồi của chất phân tích i tại mức nồng độ N;
là độ thu hồi của chất phân tích i tại mức nồng độ N;
ri.Nf là nồng độ khối lượng của chất phân tích i tìm thấy tại mức nồng độ N, được tính bằng hàm hiệu chuẩn, tính bằng microgam trên lít.
ri.Ne là nồng độ khối lượng của chất phân tích i đã cho tại mức nồng độ N, tính bằng microgam trên lít;
![]() i là độ thu hồi trung bình;
i là độ thu hồi trung bình;![]()
n là số lượng các mức nồng độ.
13.2. Định lượng bằng nội chuẩn được đánh dấu
Bằng cách cho thêm một lượng đã biết hợp chất được đánh dấu vào từng mẫu trước khi chiết, có thể hiệu chỉnh hiệu suất thu hồi vì các chất không phân cực và chất tương tự được đánh dấu có tác động tương tự dưới quá trình chiết, làm giàu và GC. Sử dụng tỷ số tương quan, Rrel, được tính theo đường chuẩn ban đầu như mô tả ở 10.2 để xác định nồng độ trực tiếp, nếu lượng hợp chất chuẩn đánh dấu được bổ sung là không đổi, sử dụng Công thức (7):
|
| A1nmL | (7) |
| A1LRrel |
Trong đó:
mex là lượng chất không phân cực trong dịch chiết, tính bằng nanogam;
A1n là diện tích ion chẩn đoán 1 đối với hợp chất tự nhiên;
A1L là diện tích ion chẩn đoán 1 đối với hợp chất đánh dấu;
mL là lượng hợp chất đánh dấu trong dung dịch chuẩn hiệu chuẩn, tính bằng nanogam;
Rrel là tỷ số tương quan được định nghĩa trong 10.2.![]()
Xác định độ thu hồi đối với mẫu nước mặt và mẫu nước thải bằng phương pháp thêm chuẩn.
Xác định độ thu hồi trung bình, ![]() i của chất phân tích i sử dụng Công thức (8) và (9):
i của chất phân tích i sử dụng Công thức (8) và (9):
|
| ri.Nf | (8) |
| ri.Ne | ||
|
|
| (9) |
| n |
|
Trong đó
hI,N là độ thu hồi chất phân tích i tại mức nồng độ N;
rI,Nf là nồng độ khối lượng của chất phân tích i tìm thấy tại mức nồng độ N, được tính bằng hàm hiệu chuẩn, tính bằng microgam trên lít;
ri,Ne là nồng độ khối lượng của chất phân tích i đã cho tại mức nồng độ N, tính bằng microgam trên lít;
![]() i là độ thu hồi trung bình;
i là độ thu hồi trung bình;
n là số mức nồng độ.
13.3. Độ thu hồi của nội chuẩn
Độ thu hồi của nội chuẩn đối với phần lớn mẫu là tương tự với độ thu hồi từ dung dịch thuốc thử. Giới hạn thu hồi trong khoảng từ 70 % đến 110 %.
Nếu độ thu hồi nội chuẩn nằm ngoài khoảng này, cần phải phân tích mẫu pha loãng.
Nếu độ thu hồi của bất kỳ nội chuẩn nào trong mẫu pha loãng nằm ngoài khoảng thông thường, cần phải phân tích dung dịch hiệu chuẩn CS3 (6.5.3) và kiểm định lại đường chuẩn. Đối với từng hợp chất, phải đảm bảo kết quả phân tích kiểm chứng nằm trong khoảng 20 % của nồng độ chuẩn. Tuy nhiên, với bất kỳ hợp chất nào nằm ngoài giới hạn tương ứng của chúng, thì hệ thống đo không phù hợp đối với hợp chất đó. Trong trường hợp này, chuẩn bị một chuẩn hiệu chuẩn mới, hoặc giải quyết các vấn đề gây ra sai sót, và chỉnh lại MS (9.5) đồng thời làm phép thử kiểm chứng, hoặc hiệu chuẩn lại (10.2).
13.4. Nồng độ trong mẫu
Tính toán nồng độ của chất không phân cực trong pha nước của mẫu sử dụng nồng độ hợp chất trong dịch chiết và thể tích nước đã chiết, như sau:
| r = | mex | (3) |
| Vs x 1000 |
Trong đó:
r là nồng độ chất không phân cực trong pha nước, tính bằng microgam trên lít;
mex là lượng hợp chất trong dịch chiết, tính bằng nanogam;
Vs là thể tích mẫu, tính bằng lít.
Báo cáo nồng độ khối lượng của hợp chất không phân cực, theo microgam trên lít, không quá hai chữ số có nghĩa. Nồng độ < 0,01 mg/l. Ví dụ được làm tròn chính xác đến 0,001 mg/l. Ví dụ làm tròn được trình bày trong Bảng 5.
Bảng 5 - Ví dụ làm tròn kết quả đo
| Giá trị đo được mg/l | Kết quả báo cáo mg/l |
| 13.54 | 14 |
| 1.354 | 1.4 |
| 0.135 4 | 0.14 |
| 0.013 5 | 0.014 |
| 0,008 6 | 0.009 |
Báo cáo thử nghiệm cần phải bao gồm ít nhất các thông tin sau:
a) Phương pháp thử đã sử dụng, cùng với viện dẫn tiêu chuẩn này;
b) Số liệu cần thiết để nhận dạng mẫu đã được kiểm tra;
c) Thông tin liên quan về lấy mẫu và bảo quản mẫu;
d) Nồng độ của từng chất không phân cực, biểu thị theo Điều 14;
e) Nếu sử dụng, chú thích về đăng ký khối lượng đơn trong quá trình phân tích MS;
f) Tất cả thao tác không quy định trong tiêu chuẩn này có ảnh hưởng đến kết quả.
(Tham khảo)
Bảng A.1 - Ví dụ về điệu kiện sắc ký
| Cột | Kích thước | Chương trình nhiệt độ |
| 95 % dimethylpolysiloxan 5 % diphenylpolysiloxan | Chiều dài: 30 m | 40 oC, 8 min đẳng nhiệt |
| Đường kính trong: 0,25 mm | 5 oC/min to 310 °C | |
| Độ dày phim: 25 mm | 15 min đẳng nhiệt | |
| 86 % dimethylpolysiloxan 14 % cyanopropylen- polysiloxan | Chiều dài: 30 m | 40 oC, 6 min đẳng nhiệt |
| Đường kính trong: 0,25 mm | 5 oC/min to 220 °C | |
| Độ dày phim: 1,0 mm | 4 min đẳng nhiệt |
(Tham khảo)
VÍ DỤ VỀ CẤU TRÚC CỦA THIẾT BỊ CHUYÊN DỤNG
Kích thước tínhh bằng milimet
CHÚ DẪN:
1 Khóa vặn PTFE
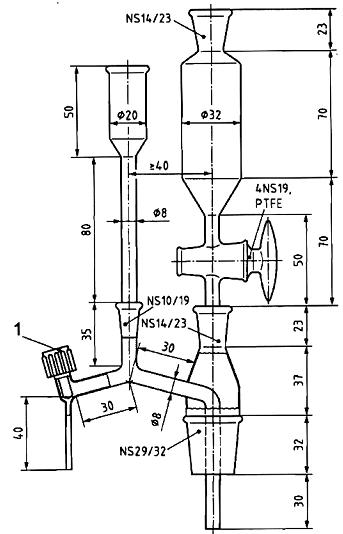
Hình B.1- Máy vi tách
| Kích thước tính bằng millimet | Kích thước tính bằng millimet |
|
|
|
| |
| CHÚ DẪN: 1 Khóa vặn PTFE Hình B.2- Ống ly tâm có đáy nhọn và nắp vặn | CHÚ DẪN: 1 ISO 383: [1] 14/23 2 Thể tích định lượng tổng, 2ml; chia vạch 0,1ml Hình B.3- Bình thu gom | |
(Tham khảo)
Để làm sạch dịch chiết, sử dụng các cột [pipet Pasteu (7.17) có nút bông thủy tinh] hoặc cột thủy tinh (7.18) có chứa ít nhất 0,5 g silica (7.19). Làm sạch silica trong cột bằng cách xả 5 thể tích hỗn hợp diclorometan (6.2.6)/hexan (6.2.1) (1+1). Sau đó thực hiện như vậy với cùng thể tích hexan (6.2.1).
CHÚ THÍCH: Việc làm sạch không thực hiện được với dung dịch có chứa axeton (6.2.3).
Làm khô dung môi đã dùng khi làm sạch dịch chiết bằng cách sử dụng rây phân tử (7.20). Silica phải có hoạt tính tối đa.
Cô đặc dịch chiết đã làm giàu (9.2.3) bằng cách thổi dòng khí nitơ vừa phải (6.3.1) sao cho thể tích còn lại 500 ml.
Sử dụng pipet Pasteu chuyển dịch chiết đã cô đặc (7.17) lên trên silica có phủ hexan và để chúng hòa gần như hoàn toàn vào silica. Thu dịch giải bằng lọ thủy tinh nhỏ (17.3)
Rửa bình thu gom bằng 500ml Hexan (6.2.1), đưa dịch lên cột để hòa tan hoàn toàn vào silica.
Rửa giải PAH bằng hỗn hợp diclorometan (6.2.6)/hexan (6.2.1) (1+1).
CHÚ THÍCH 2 Cột thủy tinh có chứa 0,5 g silica có bán sẵn ngoài thị trường cần ít nhất 3 ml hỗn hợp diclorometan (6.2.6)/hexan (6.2.1) (1+1) để rửa giải PAH.
Thêm vài giọt decan (6.2.4) hoặc izooctan (6.2.5) để rửa giải, làm đồng nhất bằng cách lắc, và cô đặc (xem 9.2.3) tới thể tích từ 200 ml đến 250 ml. Ví dụ, trước tiên làm bay hơi bằng máy cô quay (7.6) tới khoảng 2 ml, sau đó thổi dòng nitơ (6.3.1).
Làm đầy dịch chiết tới thể tích đã biết (ví dụ 2 ml) bằng dung môi đã được dùng cho chuẩn bị dung dịch hiệu chuẩn (6.5.3).
Tiến hành quy trình như mô tả ở 9.4. Sử dụng phần mẫu để xác định GC-MS.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] ISO 383, Laboratory glassware - Interchangeable conical ground joints.
[2] ISO 7981, Water quality - Determination of polycyclic aromatic hydrocacbons (PAH).
[3] ISO/TS 13530:2009, Water quality - Guidance on analytical quality control for chemical and physicochemical water analysis.
[4] ISO 15089:2000, Water quality - Guidelines for selective immunoassays for the determination of plant treatment and pesticide agents.
[5] ISO 17858:2000, Water quality - Determination of Dioxin-like polychlorinated biphenyls - Method using gas chromatography/mass spectrometry.
[6] ISO 17993:2002, Water quality - Determination of 15 polycyclic aromatic hydrocacbons (PAH) in water by HPLC with fluorescence detection after liquid-liquid extraction.
[7] ISO 10873:2004, Water quality - Determination of tetra-to octa-chlorinated dioxins and furans - method using isotope dilution HRGC/HRMS.
[8] ISO 22892:2006, Water quality - Soil quality - Guidelines for the identification of target compounds by gas chromatography and mass spectrometry.
[9] ISO 28540:2011, Water quality - Determination of 16 polycyclic aromatic hydrocacbons (PAH) in water - Method using gas chromatography with mass spectrometry detection (GC-MS).
[10] Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption. Off. J. 1998-12-05, L330, pp. 32-54.