QUY TRÌNH GIÁM ĐỊNH VI KHUẨN, VIRUS, PHYTOPLASMA GÂY BỆNH THỰC VẬT
PHẦN 2-1: YÊU CẦU CỤ THỂ ĐỐI VỚI VIRUS PLUM POX VIRUS
Procedure for identification of plant disease caused by bacteria, virus, phytoplasma
Part 2-1: Particular requirements for Plum pox virus
Lời nói đầu
TCVN 12371-2-1: 2018 do Trung tâm Giám định Kiểm dịch thực vật - Cục Bảo vệ thực vật biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 12371 Quy trình giám định vi khuẩn, virus, phytoplasma gây bệnh thực vật gồm các phần sau đây:
- Phần 2-1: Yêu cầu cụ thể đối với Plum pox virus
- Phần 2-2: Yêu cầu cụ thể đối với vi khuẩn Xylella fastidiosa Wells et al.
QUY TRÌNH GIÁM ĐỊNH VI KHUẨN, VIRUS, PHYTOPLASMA GÂY BỆNH THỰC VẬT
PHẦN 2-1: YÊU CẦU CỤ THỂ ĐỐI VỚI VIRUS PLUM POX VIRUS
Procedure for identification of plant disease caused by bacteria, virus, phytoplasma
Part 2-1: Particular requirements for Plum pox virus
Tiêu chuẩn này quy định quy trình giám định virus Plum pox virus gây bệnh thực vật.
Tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 8597: 2010, Kiểm dịch thực vật - Phương pháp luận về việc lấy mẫu chuyến hàng.
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm và các thiết bị sau:
3.1 Túi chứa mẫu: sạch
3.2 Tủ lạnh sâu: nhiệt độ từ âm 80 °C đến âm 20 °C
3.3 Lọ chứa mẫu: Kín khí, sạch
3.4 Tủ lưu trữ mẫu
3.5 Hộp lưu trữ mẫu
3.6 Lọ ngâm mẫu: bằng chất liệu trơ với hóa chất, có nắp kín
3.7 Chày cối sứ
3.8 Ống tuýp nhựa 1,5ml
3.9 Máy ly tâm
3.10 Máy chu trình nhiệt (PCR)
3.11 Máy điện di
Chỉ sử dụng các hóa chất loại tinh khiết phân tích, trừ khi có quy định khác.
4.1 Dung dịch Axit sufuric (H2SO4) 10 %
4.2 Cồn (C2H5OH) 70 %, 90 %
4.3 Nước cất 1 lần, nước cất vô trùng
4.4 Silicagel
4.5 Parafin
4.6 Glycerol
4.7 Hóa chất PCR: Natri clorit (NaCl) khan, Kali clorit (KCl), Natri hydro phosphat (Na2HPO4), Kali dihydro phosphat (KH2PO4), Tris- HCl 1M, EDTA 0,5M, Natri clorit (NaCl) 5M, PVP 40, 2 mercaptoethanol, phenol: chlorofoem:isoamyl alcohol (25:24:1), iso propanol, dry milk solution, SDS, ammonium acetate 7,5M, PCR Buffer 10x, dNTPs 2.0nM, Primers, Taq polymerase, agarose, loading dye
5.1.1 Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước
Lấy mẫu theo TCVN 8597: 2010
5.1.2 Đối với cây trồng ngoài đồng ruộng
- Diện tích điều tra: phụ thuộc vào loại cây trồng, điều kiện cụ thể tại vùng điều tra và mục đích điều tra.
- Chọn điểm điều tra: Có thể chọn điểm điều tra thẹo một trong số các phương pháp sau
Chọn điểm theo đường chéo góc (hình 1)
Hình 1 - Điểm điều tra lấy theo đường chéo góc
(NGUỒN: Viện Bảo vệ thực vật, 1997)
Chọn điểm theo ô bàn cờ (hình 2)
Hình 2 - Điểm điều tra lấy theo ô bàn cờ
(NGUỒN: Viện Bảo vệ thực vật, 1997)
Chọn điểm hình rẻ quạt (hình 3)
Hình 3 - Điểm điều tra lấy theo hình rẻ quạt
(NGUỒN: Viện Bảo vệ thực vật, 1997)
Chọn điểm ngẫu nhiên (hình 4)

Hình 4 - Điểm điều tra lấy theo ngẫu nhiên
(NGUỒN: Viện Bảo vệ thực vật, 1997)
Điều tra toàn bộ ruộng theo băng (hình 5). Tại ruộng điều tra, điều tra toàn bộ ruộng theo phương pháp cuốn chiếu theo băng. Mỗi ruộng được chia ra làm các băng nhỏ, mỗi băng có chiều rộng 2 m, điều tra lần lượt từ đầu tới cuối băng và kiểm tra toàn bộ cây trồng trong mỗi băng điều tra.
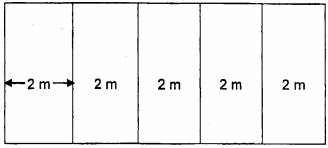
Hình 5 - Điều tra toàn bộ ruộng theo băng
- Số lượng mẫu: số lượng mẫu phụ thuộc vào mục đích điều tra và phương pháp lấy mẫu.
Cây ăn quả, cây lâu năm, cây công nghiệp: số lượng cây điều tra tại một điểm tối thiểu từ 3 cây đến 5 cây.
Cây hàng năm, rau màu, cây ngắn ngày: mỗi điểm có diện tích tối thiểu là 1 m2.
Thu toàn bộ các bộ phận có triệu chứng nghi bị nhiễm Plum pox virus.
Các bộ phận tươi (cành, lá, thân, quả) được chứa trong các túi chứa mẫu (3.1) bảo quản trong tủ lạnh sâu (3.2) ở nhiệt độ âm 80 °C.
Các mẫu tươi sau khi giám định hoặc gửi đi giám định có thể xử lý theo một số phương pháp như làm mẫu khô hoặc ngâm mẫu
Làm mẫu khô:
Bộ phận nhiễm bệnh (lá hoặc cành) được đặt trong túi chứa mẫu có chứa silicagel. (Chú ý thay silicagel mới khi phần cũ đã hút ẩm tối đa)
Mẫu đạt tiêu chuẩn là các mẫu không bị mốc, khô hoàn toàn, không bị gập gãy hoặc nhăn nheo.
Các mẫu vật sau khi ép khô được đặt trong các túi chứa mẫu bằng giấy bên ngoài đề rõ các thông tin liên quan như: ngày, tháng lấy mẫu; thông tin kí chủ; thông tin bệnh hại (hoặc nghi ngờ loại bệnh hại); địa điểm (hoặc lô hàng lấy mẫu).
Các túi chứa mẫu bằng giấy được lưu trữ trong các tủ lưu trữ mẫu (3.4) (hoặc các hộp (3.5)) có độ ẩm thấp (có thể sử dụng các vật liệu chống ẩm như silicagel...)
Ngâm mẫu:
Bộ phận nhiễm bệnh (cành, lá, quả tươi) được rửa nhẹ dưới với nước chảy sau đó rửa lại bằng nước cất vô trùng.
Mẫu được để chỗ thoáng để bề mặt khô hoàn toàn.
Có thể ngâm mẫu vào dung dịch H2SO4 10 % bổ sung thêm glycerol 0,01 % và cồn 90 % 0,01 % trong vòng 24 giờ.
Vớt mẫu vật ra, rửa trong nước lạnh.
Chuyển mẫu vào lọ ngâm mẫu (3.6) có chứa dung dịch bảo quản (Xem phụ lục B) và đậy chặt nắp.
……
Bước 9: loại bỏ dịch ở ống 2 ml
Bước 10: thêm vào cột ly tâm màu hồng 700 μl đệm RW1
Bước 11: ly tâm ở 10.000 vòng/phút trong 15 giây
Bước 12: loại bỏ dịch ở ống 2 ml
Bước 13: ly tâm ở 10.000 vòng/phút trong 2 phút
Bước 14: đặt cột ly tâm màu hồng vào ống ly tâm 1,5 ml mới
Bước 15: thêm 30 μl Rnase-free water vào cột ly tâm màu hồng
Bước 13: ly tâm ở 10.000 vòng/phút trong 1 phút
7.2.2 Nhân gen (RT-PCR)
DNA thu được tiến hành nhân gen trong máy chu trình nhiệt (PCR) (3.10) với quy trình như sau:
Bước 1: Pha dung dịch nhân gen (master mix)
Master mix A
| Nước cất vô trùng | 1 μl |
| 5x first strand buffer | 2 μl |
| 40U/μl RNAsin Plus | 1 μl |
| Mồi | 2 μl |
| RNA khuôn | 2 μl |
Bước 2: Ủ trong điều kiện 70 °C trong 10 phút
Bước 3: Ly tâm 10.000 vòng/phút trong 30 giây
Bước 4: Đặt ở nhiệt độ phòng 15 phút
Bước 5: Pha dung dịch nhân gen (master mix)
Master mix B
| 0,1M DTT | 1,0 μl |
| 40U/μl RNAsin Plus | 0,25 μl |
| 10nM dNTPs | 0,5 μl |
| Reverse transcriptase | 0,25 μl |
Bước 6: trộn 2μl master mix B với 8 μl master mix A
Bước 7: Ủ ở 42°C đến 50 °C trong 1 giờ
Bước 8: Qua 7 bước trên ta thu được cDNA từ đó tiến hành nhân gen như sau
| 10x PCR buffer | 2 μl |
| Nước cất vô trùng | 12,2 μl |
| 25 nM MgCl2 | 1,2 μl |
| 10 mM dNTPs | 0,4 μl |
| 5 μM mồi P1/P2 | 2 μl |
| Taq polymerase (5 U/μl) | 0,2 μl |
| cNDA | 2 μl |
| Tổng | 20 μl |
Sử dụng cắp mồi đặc hiệu (nguồn Wetzel et al.)
P1 (5’-ACC GAG ACC ACT ACA CTC CC-3’)
P2 (5’-CAG ACT ACA GCC TCG CCA GA-3’)
Bước 8: nhân gen trong máy với chu trình nhiệt như sau:
| 45 °C trong 45 phút 94 °C trong 2 phút 94 °C trong 30 giây 60 °C trong 30 giây 72 °C trong 1 phút 72 °C trong 10 phút | Chu trình lặp lại 40 lần |
7.2.3. Đọc kết quả
Gen sau khi nhân được nhuộm bằng chất nhuộm (thường là Loading dye) sau đó được đặt vào máy điện di (3.11) trong bản gel agarose 2 %.
Mẫu dương tính cho đoạn gen có kích thước 243 kb
Mẫu giám định được kết luận là loài Plum pox virus khi:
- Phương pháp ELISA cho kết quả là dương tính,
hoặc
- Phương pháp RT- PCR cho kết quả là dương tính.
Sau khi khẳng định kết quả giám định, người giám định hoặc cơ quan giám định trả lời kết quả bằng phiếu. Nội dung phiếu kết quả giám định gồm những thông tin sau:
- Thông tin về mẫu giám định.
- Tên loài
- Phương pháp giám định
- Người giám định/cơ quan giám định
Phiếu giám định chi tiết có thể tham khảo phụ lục D.
A.1 Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh virus đốm tròn quả mận
Tên khoa học: Plum pox virus
Tên khác (Syn.):
Annulus pruni
Plum pox potyvirus
Prunus virus 7
Sharks virus
Vị trí phân loại
Họ: Potyviridae
Chi: Potyvirus
A.2 Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Châu Á: Ấn Độ, Pakistan, Turkey, Iran, Israel, Nhật Bản, Kazakhstan, Trung Quốc, Jordan, Syria, Azerbaijan; Châu Phi: Ai Cập, Tunisia; Châu Mỹ: Chile, Canada, Hoa Kỳ, Argentina; Châu Âu: Bulgaria , Croatia, Czech, Germany, Greece, Hungary, Moldova, Montenegro, Poland, Romania, Serbia, Slovakia, Slovenia, Yugoslavia (Serbia and Montenegro), Albania, Austria, Cyprus, France, Italy, Norway, Portugal, Russia, Spain, UK (England & Wales), Ukraine, Belarus, Bosnia Herzegovina, Latvia, Luxembourg, Belgum, Lithuania, Netherlands, Switzeland.
A.3 Ký chủ
Ký chủ chính: Prunus americana, Prunus angustifolia, Prunus armeniaca (mơ), Prunus cistena, Prunus davidiana, Prunus domestica (mận), Prunus dulcis (hạnh), Prunus emarginata, Prunus fruticosa, Prunus hortulana, Prunus humilis, Prunus ilicifolia, Prunus maackii, Prunus mahaleb, Prunus maritima, Prunus mexicana, Prunus nigra, Prunus padus, Prunus pensylvanica, Prunus persica (đào), Prunus pumila var. besseyi, Prunus pumila var. depressa, Prunus saliclna (mận Nhật Bản), Prunus sargentii, Prunus serrulata, Prunus subhirtella, Prunus tenella, Prunus tomentosa, Prunus triloba, Prunus virginiana, Prunus virginiana var. demissa, Prunus yedoensis,
Ký chủ khác: Cichorlum, Cirsium arvense, Clematis, Convolvulus arvensis, Euonymus europaeus, Juglans regia (óc chó), Ligustrum vulgare, Prunus avium (anh đào), Prunus besseyi, Prunus cerasifera, Prunus glandulosa, Prunus japonica, Prunus spinosa (mận gai), Rorippa sylvestris, Solanum nigrum (cây tầm bóp), Sonchus, Taraxacum officinale complex (bồ công anh), Trifolium (cỏ ba lá)
A.4 Đặc điểm sinh học
Virus gây hại chính trên những cây thuộc chi Prunus. Virus lan truyền bằng việc ghép cây, qua hai loài rệp chính Aphis spiraecola và Myzus persicae, ngoài ra còn một số loài rệp khác cũng có thể truyền virus với tần suất thấp như: Aphis craccivora, Aphis fabae, Brachycaudus cardui, Brachycaudus helychrysi, Brachycaudus persicae, Hyalopterus pruni, Myzus varians và Phorodon humulr, Aphis gossypii, Metopolophium dirhodum và Toxoptera citricida. Virus truyền bệnh bằng môi giới theo phương thức không bền vững.
Những cây họ Prunus bị nhiễm là nguồn lây nhiễm chính. Virus lan truyền từ cây bị bệnh qua việc ghép cây hoặc vector là rệp Aphis spiraecola và Myzus persicae. Virus truyền bệnh bằng môi giới theo phương thức không bền vững.
Các loài rệp khác truyền virus với tần suất thấp hơn so hài vector chính như Aphis craccivora, Aphis fabae, Brachycaudus cardui, Brachycaudus helychrysi, Brachycaudus persicae, Hyalopterus pruni, Myzus varians và Phorodon humuli (Kunze and Krczal, 1971; Leclant, 1973). Gần đây, tại Tây Ban Nha, Avinent và công sự (1994) đã thêm Aphis gossypii vào danh sách vector phụ "minor vector” truyền virus, trong khi đó ở Pháp, Labonne và cộng sự (1994) đã cho biết loài Aphis hederae và Rhopalosiphum padi truyền virus PPV rất tốt trên cây thân thảo. Trong thí nghiệm, Gildow và cộng sự (2004) đã bổ sung vector Metopolophium dirhodum (rệp hạt hoa hồng) và Toxoptera citricida (rệp nâu cam quýt) truyền virus PPV.
Số lượng cây bị bệnh trong vườn liên quan trực tiếp đến mùa vụ và số lượng rệp có cánh. Những con rệp đi tìm kiếm thức ăn hoặc ăn trên lá bị bệnh sau đó bay đến những cây khác cũng để tìm kiếm thức ăn hoặc ăn. Theo Gottwald và cộng sự (1995) đã kết luận rằng rệp lây bệnh sang cây xa hơn cây liền kề, sau khi phân tích về khu vực phát tán của rệp (aphid-borne) ở miền Đông Tây Ban Nha.
Vào mùa hè, các con rệp cũng có thể di chuyển tới những cây thân thảo trong vườn và trở lại những cây ăn quả để đẻ trứng vào mùa đông (Kunze and Krczal, 1971). Phorodon humuli bỏ đói sau khi ăn 2- 3 giờ có thể truyền virus PPV (Krczal and Kunze, 1972). Khả năng của vector truyền bệnh giữa các chúng khác nhau đáng kể (Massonié and Maison, 1976). Sau khi lây nhiễm, thời gian ủ bệnh có thể kéo dài vài tháng và lan vào hệ thống cây thân gỗ có thể mất vài năm (OEPP/EPPO, 1983). Do đó virus có thể phân bố đều trong cây.
Theo Németh và Kölber (1983), virus truyền qua hạt họ Prunus, nhưng điều này chưa được xác minh bởi những người làm khác trong suốt 15 năm và trong thực tế là không biết. Những nghiên cứu khác đã không tìm thấy bằng chứng virus này truyền qua hạt họ Prunus (Pasquini and Barba, 2006).
Thành phần và chuẩn bị dung dịch xử lý mẫu
Dung dịch bảo quản
Có thể sử dụng một trong những dung dịch bảo quản sau:
Dung dịch 1:
| CuSO4 | 85 g |
| H2SO3 | 28,4 ml |
| Nước | 2485 ml |
Dung dịch 2:
H2SO3 | 284 ml |
| Nước | 3785 ml |
Dung dịch 3:
| Muối bão hòa | 1.000 ml |
| Fomalin | 500 ml |
| Nước | 870 ml |
Dung dịch 4:
| Fomalin | 450 ml |
| Cồn | 540 ml |
| Nước | 1.810 ml |
Cách pha dung dịch muối bão hòa:
Hòa tan muối trong nước nóng đến mức độ bão hòa. Để dung dịch nguội trong 3 giờ.
Lọc bỏ phần không tan hết
CHÚ THÍCH: Xylene, phenol là các chất độc hại, tránh tiếp xúc trực tiếp với da trần, sử dụng găng tay, khẩu trang và dụng cụ bảo hộ lao động trong thời gian tiếp xúc với các hóa chất này
C.1 PBS
Thành phần
| NaCl | 8g |
| KCl | 0,2 g |
| Na2HPO4 | 2,9 g |
| KH2PO4 | 0,2 g |
| Nước | 1.000 ml |
C.2 CTAB
Thành phần
| CTAB | 2 g |
| Tris HCl 1 M | 10 ml |
| EDTA 0,5 M | 4 ml |
| NaCl 5M | 28 ml |
| PVP 40 | 1 g |
| Nước | 100 ml |
C.3 TE
Thành phần
| Tris HCl 1 M | 1 ml |
| EDTA 0,5 M | 0,2 ml |
| Nước | 100 ml |
| Cơ quan Bảo vệ và Kiểm dịch thực vật …………………………… | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM |
……………, ngày... tháng ... năm 20……
PHIẾU KẾT QUẢ GIÁM ĐỊNH
1. Tên hàng hoá:
2. Nước xuất khẩu:
3. Xuất xứ:
4. Phương tiện vận chuyển: Khối lượng:
5. Địa điểm lấy mẫu:
6. Ngày lấy mẫu:
7. Người lấy mẫu:
8. Tình trạng mẫu:
9. Ký hiệu mẫu:
10. Số mẫu lưu:
11. Người giám định:
12. Phương pháp giám định: Theo TCVN 12371-2-1:2018, Quy trình giám định bệnh vi khuẩn, virus, phytoplasma gây bệnh thực vật. Phần 2-1: Yêu cầu cụ thể đối với virus Plum pox virus.
13. Kết quả giám định:
Tên khoa học: Plum pox virus
Vị trí phân loại
Họ: Potyviridae
Giống: Potyvirus
| TRƯỞNG PHÒNG KỸ THUẬT | THỦ TRƯỞNG ĐƠN VỊ |
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] CABI, (2017), Crop Protection Compedium.
[2] Commonwealth Mycologycal Institute, (1983), Plant Pathologist's Pocketbook.
[3] IPPC, (2006), ISPM 27 Diagnostic protocols for regulated pests.
[4] TCVN 8597: 2010, Kiểm dịch thực vật - Phương pháp luận về việc lấy mẫu chuyến hàng.
[5] Viện Bảo vệ thực vật, (1997), Tập 1: Phương pháp điều tra cơ bản dịch hại nông nghiệp và thiên địch của chúng, Phương pháp nghiên cứu bảo vệ thực vật.. NXB Nông nghiệp.
[6] Wetzel T, Candresse T, Ravelonandro M, Dunez J, (1991), A polymerase chain reaction assay adapted to plum pox potyvirus detection. Journal of Virological Methods 33, 355- 365.
[7] http://www.apsnet.org/publications/apsnetfeatures/pages/plumpoxpotyvirus.aspx.
[8] http://www.planthealthaustralia.com.au/pests/plum-pox-virus/
[9] https://www.aphis.usda.gov/aphis/ourfocus/planthealth/plant-pest-and-disease-programs/pests- and-diseases/plum-pox/ct_background

