- 1 Tiêu chuẩn quốc gia TCVN 8129:2009 (ISO 18593 : 2004) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp lấy mẫu bề mặt sử dụng đĩa tiếp xúc và lau bề mặt
- 2 Tiêu chuẩn Việt Nam TCVN 6507-1:2005 (ISO 6887-1 : 1999) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân do Bộ Khoa học và Công nghệ ban hành
- 3 Tiêu chuẩn Việt Nam TCVN 6507-2:2005 (ISO 6887-2 : 2003) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 2: Các nguyên tắc cụ thể để chuẩn bị các mẫu thịt và sản phẩm thịt do Bộ Khoa học và Công nghệ ban hành
- 4 Tiêu chuẩn Việt Nam TCVN 6507-3:2005 (ISO 6887 – 3 : 2003) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 3: Các nguyên tắc cụ thể để chuẩn bị các mẫu thuỷ sản và sản phẩm thuỷ sản do Bộ Khoa học và Công nghệ ban hành
- 5 Tiêu chuẩn Việt Nam TCVN 6507-4:2005 (ISO 6887- 4 : 2003) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 4: Các nguyên tắc cụ thể để chuẩn bị các sản phẩm khác với sữa và sản phẩm sữa, thịt và sản phẩm thịt thuỷ sản và sản phẩm thuỷ sản do Bộ Khoa học và Công nghệ ban hành
- 6 Tiêu chuẩn quốc gia TCVN 6507-5:2013 (ISO 6887-5:2010) về vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 5: Các nguyên tắc cụ thể để chuẩn bị mẫu sữa và sản phẩm sữa
- 7 Tiêu chuẩn quốc gia TCVN 6507-6:2015 (ISO 6887-6:2013) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 6: Các nguyên tắc cụ thể để chuẩn bị mẫu được lấy từ giai đoạn sản xuất ban đầu
- 8 Tiêu chuẩn quốc gia TCVN 10782:2015 (ISO 13307:2013) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Giai đoạn sản xuất ban đầu - Kỹ thuật lấy mẫu
- 9 Tiêu chuẩn quốc gia TCVN 8128:2015 (ISO 11133:2014) về Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy
- 10 Tiêu chuẩn quốc gia TCVN 6404:2016 (ISO 7218:2007 with amendment 1:2013) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
- 11 Tiêu chuẩn quốc gia TCVN 11922:2017 (ISO 17468:2016) về Vi sinh vật trong chuỗi thực phẩm - Yêu cầu và hướng dẫn kỹ thuật để xây dựng hoặc soát xét phương pháp chuẩn đã được chuẩn hóa
- 12 Tiêu chuẩn quốc gia TCVN 11923:2017 (ISO/TS 17728:2015) về Vi sinh vật trong chuỗi thực phẩm - Kỹ thuật lấy mẫu để phân tích vi sinh vật trong thực phẩm và thức ăn chăn nuôi
- 13 Tiêu chuẩn quốc gia TCVN 11924:2017 (ISO/TS 18867:2015) về Vi sinh vật trong chuỗi thực phẩm - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Phát hiện Yersinia enterocolitica gây bệnh và Yersinia pseudotuberculosis
- 14 Tiêu chuẩn quốc gia TCVN 12365-2:2018 (ISO 16140-2:2016) về Vi sinh vật trong chuỗi thực phẩm - Xác nhận giá trị sử dụng phương pháp - Phần 2: Quy trình xác nhận giá trị sử dụng phương pháp thay thế so với phương pháp chuẩn
- 15 Tiêu chuẩn quốc gia TCVN 12365-1:2018 (ISO 16140-1:2016) về Vi sinh vật trong chuỗi thực phẩm - Xác nhận giá trị sử dụng phương pháp - Phần 1: Thuật ngữ và định nghĩa
- 16 Tiêu chuẩn quốc gia TCVN 7925:2018 (ISO 17604:2015) về Vi sinh vật trong chỗi thực phẩm - Lấy mẫu thân thịt để phân tích vi sinh vật
TI�U CHUẨN QUỐC GIA
ISO 10273:2017
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHƯƠNG PH�P PH�T HIỆN YERSINIA ENTERROCOLITICA G�Y BỆNH
Microbiology of the food chain - Horizontal method for the detection of pathogenic Yersinia enterocolitica
TCVN 8127:2018 thay thế TCVN 8127:2009;
TCVN 8127:2018 ho�n to�n tương đương với ISO 10273:2017;
TCVN 8127:2018 do Ban kỹ thuật ti�u chuẩn quốc gia TCVN/TC/F13 Phương ph�p ph�n t�ch v� lấy mẫu bi�n soạn, Tổng cục Ti�u chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học v� C�ng nghệ c�ng bố.
Ti�u chuẩn n�y quy định phương ph�p ph�t hiện Yersinia enterocolitica g�y bệnh cho con người. Do t�nh đa dạng của thực phẩm v� thức ăn chăn nu�i n�n phương ph�p n�y c� thể kh�ng th�ch hợp đến từng chi tiết cho từng sản phẩm cụ thể v� đối với một số sản phẩm kh�c cần sử dụng c�c phương ph�p kh�c nhau. Trong trường hợp n�y, c� thể sử dụng c�c phương ph�p kh�c đặc trưng cho từng sản phẩm, nếu ho�n to�n chỉ v� l� do kỹ thuật. Tuy nhi�n, cần cố gắng �p dụng phương ph�p n�y khi c� thể.
Việc h�i h�a c�c phương ph�p thử c� thể kh�ng thực hiện được ngay v� đối với một v�i nh�m sản phẩm c� thể tồn tại c�c ti�u chuẩn quốc tế v�/hoặc ti�u chuẩn quốc gia m� kh�ng ph� hợp với ti�u chuẩn n�y. Th�ng thường khi c�c ti�u chuẩn như thế được so�t x�t th� ch�ng phải được sửa đổi để ph� hợp với ti�u chuẩn n�y, sao cho chỉ giữ lại c�c phần của phương ph�p n�y cần cho c�c l� do kỹ thuật được thừa nhận.
VI SINH VẬT CHUỖI THỰC PHẨM - PHƯƠNG PH�P PH�T HIỆN YERSINIA ENTEROCOLITICA G�Y BỆNH
Microbiology of food chain - Horizontal method for the detection of pathogenic Yersinia enterocolitica
CẢNH B�O - Để bảo vệ sức khỏe của nh�n vi�n ph�ng thử nghiệm, điều cần thiết l� c�c ph�p thử ph�t hiện Yersinia enterocolitica g�y bệnh chỉ được thực hiện trong c�c ph�ng thử nghiệm được trang bị đầy đủ, dưới sự kiểm so�t của nh� vi sinh vật học c� kỹ năng v� cẩn thận khi thải bỏ tất cả c�c vật liệu đ� ủ. Người sử dụng ti�u chuẩn n�y phải c� kinh nghiệm với thực h�nh ph�ng thử nghiệm th�ng thường. Ti�u chuẩn n�y kh�ng đề cập đến tất cả c�c kh�a cạnh an to�n, nếu c�, chỉ li�n quan đến việc sử dụng ti�u chuẩn. Người sử dụng c� tr�ch nhiệm thiết lập c�c vấn đề an to�n v� sức khỏe ph� hợp v� đảm bảo tu�n thủ c�c quy định hiện h�nh.
1 �Phạm vi �p dụng
Ti�u chuẩn n�y quy định phương ph�p ph�t hiện Y. enterocolitica g�y bệnh cho con người. Ti�u chuẩn n�y c� thể �p dụng cho:
- c�c sản phẩm thực phẩm v� thức ăn chăn nu�i; v�
- c�c mẫu m�i trường trong khu vực sản xuất v� chế biến thực phẩm.
2 �T�i liệu viện dẫn
C�c t�i liệu viện dẫn sau rất cần thiết cho việc �p dụng ti�u chuẩn n�y. Đối với c�c t�i liệu viện dẫn ghi năm c�ng bố th� �p dụng phi�n bản được n�u. Đối với c�c t�i liệu viện dẫn kh�ng ghi năm c�ng bố th� �p dụng phi�n bản mới nhất, bao gồm cả c�c sửa đổi, bổ sung (nếu c�).
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm v� thức ăn chăn nu�i - Y�u cầu chung v� hướng dẫn kiểm tra vi sinh vật
TCVN 6507 (ISO 6887) (tất cả c�c phần), Vi sinh vật trong thực phẩm v� thức ăn chăn nu�i - Chuẩn bị mẫu thử, dung dịch huyền ph� ban đầu v� c�c dung dịch pha lo�ng thập ph�n để kiểm tra vi sinh vật
TCVN 8128:2015 (ISO 11133:2014), Vi sinh vật trong thực phẩm, thức ăn chăn nu�i v� nước - Chuẩn bị, sản xuất, bảo quản v� thử hiệu năng của m�i trường nu�i cấy
3 �Thuật ngữ v� định nghĩa
Trong ti�u chuẩn n�y sử dụng c�c thuật ngữ v� định nghĩa sau đ�y:
3.1
Yersinia enterocolitica g�y bệnh (pathogenic Yersinia enterocolitica)
Vi khuẩn ưa lạnh tạo th�nh c�c khuẩn lạc đặc trưng tr�n m�i trường đặc chọn lọc v� c� c�c đặc t�nh sinh h�a v� ph�n tử đ�p ứng c�c ti�u ch� về t�nh g�y bệnh như m� tả, khi tiến h�nh ph�p thử khẳng định theo ti�u chuẩn n�y.
Ph�t hiện Yersinia enterocolitica g�y bệnh (detection of pathogenic Yersinia enterocolitica)
X�c định sự c� mặt hay kh�ng c� mặt vi khuẩn Yersinia enterocolitica (3.1) trong một lượng hoặc một thể t�ch x�c định của sản phẩm hoặc bề mặt quy định, khi tiến h�nh thử theo ti�u chuẩn n�y.
4 �Từ viết tắt
Trong ti�u chuẩn n�y sử dụng c�c từ viết tắt sau đ�y:
| CEB | Canh thang tăng sinh lạnh (cold enrichment broth) |
| CIN | Cefsulodin, Irgasan� v� Novobiocin (cefsulodin, Irgasan� and Novobiocin) |
| CR-MOX | Đỏ congo magie-oxalat (congo red magnesium-oxalate) |
| ITC | Irgasan�, Ticarcillin v� kali clorat (Irgasan�, Ticarcillin and potassium chlorate) |
| KOH | kali hydroxit (potassium hydroxide) |
| MRB | canh thang rappaport cải biến (modified rappaport broth) |
| PCR | phản ứng chuỗi polymerase (polymerase chain reaction) |
| PSB | pepton, sorbitol v� muối mật (peptone, sorbitol and bile salts) |
| TSB | canh thang tryptic đậu tương (tryptic soy broth) |
| WDCM | Trung t�m dữ liệu thế giới về vi sinh vật (World data centre for microorganisms) |
5 �Nguy�n tắc
5.1 �Y�u cầu chung
Việc ph�t hiện Y. enterocolitica g�y bệnh bao gồm bốn giai đoạn li�n tiếp (xem Phụ lục A về sơ đồ quy tr�nh v� khẳng định). Ngo�i c�c quy tr�nh chung, v� dụ trong điều tra dịch bệnh, c� thể sử dụng quy tr�nh tăng sinh lạnh t�y chọn như trong Phụ lục D.
5.2 �Nu�i cấy trực tiếp từ m�i trường tăng sinh lỏng
Mẫu đ� được đồng nhất, cho v�o m�i trường tăng sinh lỏng (canh thang PSB), sau đ� cấy một lượng quy định v�o hai đến bốn thạch đĩa CIN[15]. Ủ c�c đĩa đ� nu�i cấy ở 30 �C trong 24 h.
CH� TH�CH: Cũng c� thể sử dụng th�m c�c đĩa m�i trường thạch sinh m�u để ph�t hiện Y. enterocolitica g�y bệnh [9,13,18].
5.3 �Tăng sinh trong m�i trường tăng sinh lỏng chọn lọc v� m�i trường tăng sinh lỏng
Chuyển một lượng quy định của mẫu thử được nu�i cấy trong m�i trường tăng sinh PSB (5.2) v�o canh thang tăng sinh chọn lọc ITC [17]. Canh thang ITC v� huyền ph� PSB ban đầu được ủ ở 25 �C trong 44 h.
5.4 �Cấy đĩa sau khi tăng sinh v� nhận dạng
Từ dịch cấy tăng sinh thu được trong 5.3, cấy l�n bề mặt thạch đĩa CIN bằng c�ch đầu ti�n chuyển một lượng quy định dịch cấy tăng sinh (5.3, xem Điều 10 về c�ch tiến h�nh) v�o dung dịch KOH 0,5 % v� sau khi trộn đều trong một khoảng thời gian x�c định (xử l� bằng KOH hoặc kiềm), cấy l�n đĩa CIN. C�c đĩa ria cấy được ủ ở 30 �C trong 24 h. Nhận biết c�c khuẩn lạc điển h�nh của Y. enterocolitica g�y bệnh (xem 10.5) v� x�c nhận h�nh th�i khuẩn lạc như l� Y. enterocolitica giả định tr�n đĩa thạch chọn lọc (xem 10.5).
CH� TH�CH: Cũng c� thể sử dụng th�m c�c đĩa như m�i trường thạch sinh m�u để ph�t hiện Y. enterocolitica g�y bệnh [9,13,18].
5.5 �Khẳng định
Từ c�c khuẩn lạc Yersinia enterocolitica g�y bệnh giả định (5.2 v� 5.4), khẳng định Y. enterocolitica g�y bệnh bằng c�c ph�p thử khẳng định ph�n tử hoặc/v� c�c ph�p thử sinh h�a th�ch hợp (xem 10.6 v� H�nh A.2).
6 �Thuốc thử v� m�i trường nu�i cấy
Về thực h�nh trong ph�ng thử nghiệm hiện h�nh, xem TCVN 6404 (ISO 7218).
Về c�c y�u cầu cụ thể về đảm bảo chất lượng v� hiệu năng của m�i trường, xem Phụ lục B của TCVN 8128 (ISO 11133).
Th�nh phần của m�i trường nu�i cấy, thuốc thử v� quy tr�nh chuẩn bị được n�u trong Phụ lục B. Ngo�i ra, cũng c� thể sử dụng c�c m�i trường ho�n chỉnh kh�, c�c dịch pha lo�ng hoặc m�i trường chuẩn bị c� sẵn tu�n thủ theo hướng dẫn của nh� sản xuất.
7 �Thiết bị, dụng cụ v� vật tư
C� thể d�ng dụng cụ sử dụng một lần thay thế cho dụng cụ thủy tinh sử dụng nhiều lần, nếu c� c�c quy định th�ch hợp. Sử dụng c�c thiết bị, dụng cụ của ph�ng thử nghiệm vi sinh th�ng thường [TCVN 6404 (ISO 7218)] v� cụ thể như sau:
7.1 �Thiết bị khử tr�ng kh� (tủ sấy) hoặc thiết bị khử tr�ng ướt (nồi hấp �p lực)
Theo quy định trong TCVN 6404 (ISO 7218).
7.2 �Tủ ấm, theo quy định trong TCVN 6404 (ISO 7218), c� thể duy tr� nhiệt độ ở 4 �C � 2 �C, 25 �C � 1 �C, 30 �C � 1 �C v� 37 �C � 1 �C.
7.3 �T�i trộn, ống nghiệm, chai v�/hoặc b�nh cầu v� tr�ng, c� dung t�ch th�ch hợp.
7.4 �Đĩa Petri, bằng thủy tinh hoặc bằng chất dẻo, c� đường k�nh 90 mm v� k�ch thước lớn (đường k�nh khoảng 140 mm (t�y chọn).
7.5 �Pipet chia vạch hoặc tự động, c� miệng rộng, dung t�ch danh định 1 ml v� 10 ml v� được chia vạch tương ứng 0,1 ml v� 0,5 ml v� pipet Pasteur.
7.6 �Que cấy v�ng v� bộ d�n mẫu. V�ng cấy v� tr�ng đường k�nh khoảng 6 mm (thể t�ch 10 �l), que cấy thẳng hoặc d�y kim loại. Bộ d�n mẫu chữ T hoặc chữ L d�ng một lần. Tăm b�ng (xem Phụ lục D).
7.7 �K�nh hiển vi soi nổi, được trang bị đ�n chiếu s�ng truyền qua trường tối hoặc chếch một g�c (g�c 45�).
7.8 �M�y trộn nhu động.
8 �Lấy mẫu
Việc lấy mẫu kh�ng quy định trong ti�u chuẩn n�y, xem ti�u chuẩn cụ thể ph� hợp cho sản phẩm c� li�n quan. Nếu kh�ng c� ti�u chuẩn cụ thể th� c�c b�n li�n quan cần thỏa thuận về vấn đề n�y.
N�n sử dụng c�c kỹ thuật lấy mẫu quy định trong c�c ti�u chuẩn sau:
- TCVN 11923 (ISO/TS 17728) đối với thực phẩm v� thức ăn chăn nu�i;
- TCVN 10782 (ISO 13307) đối với giai đoạn sản xuất ban đầu;
- TCVN 7925 (ISO 17604) đối với th�n thịt;
- TCVN 8129 (ISO 18593) đối với c�c mẫu m�i trường.
Điều quan trọng l� ph�ng thử nghiệm nhận được đ�ng mẫu đại diện v� kh�ng bị hư hỏng hoặc biến đổi trong qu� tr�nh vận chuyển v� bảo quản.
9 �Chuẩn bị mẫu thử
Chuẩn bị mẫu thử từ mẫu ph�ng thử nghiệm theo ti�u chuẩn cụ thể c� li�n quan đến sản phẩm. Nếu kh�ng c� ti�u chuẩn cụ thể th� c�c b�n c� li�n quan cần thỏa thuận về vấn đề n�y.
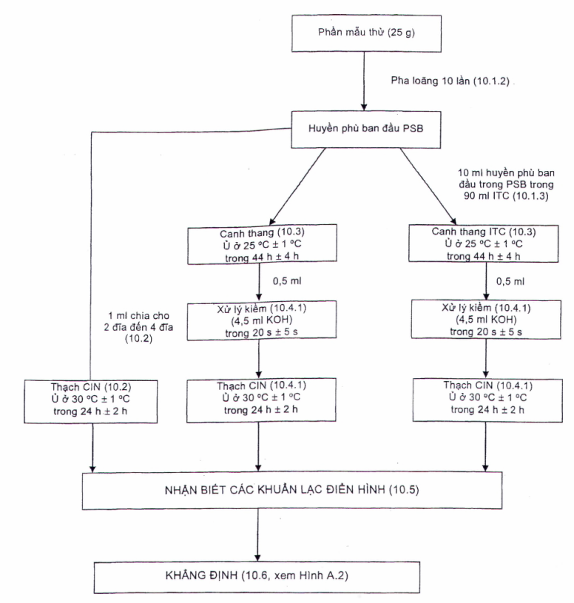
10 �C�ch tiến h�nh (xem Phụ lục A)
10.1 �Phần mẫu thử v� huyền ph� ban đầu
10.1.1 �Xem phần c� li�n quan của bộ TCVN 6507 (ISO 6887) (tất cả c�c phần) hoặc ti�u chuẩn th�ch hợp đối với sản phẩm c� li�n quan.
10.1.2 �Trong trường hợp chung, để chuẩn bị huyền ph� ban đầu, sử dụng m�i trường tiền tăng sinh l�m dịch pha lo�ng như quy định trong B.2 (canh thang PSB). L�m ấm trước canh thang PSB đến nhiệt độ ph�ng trước khi sử dụng.
Th�ng thường, một lượng mẫu thử (khối lượng hoặc thể t�ch) được cho v�o một lượng PSB (khối lượng hoặc thể t�ch) để tạo ra dung dịch pha lo�ng mười lần. Thường l� 25 g mẫu thử được trộn với 225 ml PSB.
Đồng h�a huyền ph� n�y bằng c�ch sử dụng m�y trộn nhu động (7.8) trong 1 min.
Ti�u chuẩn n�y đ� được x�c nhận gi� trị sử dụng cho c�c phần mẫu thử 25 g hoặc 25 ml. C� thể sử dụng một phần thử nhỏ hơn, m� kh�ng cần x�c nhận gi� trị sử dụng/kiểm tra bổ sung, với điều kiện l� duy tr� được c�ng tỷ lệ giữa canh thang tăng sinh với phần mẫu thử. C� thể sử dụng phần mẫu thử lớn hơn so với lượng được x�c nhận ban đầu, nếu nghi�n cứu x�c nhận gi� trị sử dụng/kiểm tra cho thấy kh�ng ảnh hưởng đến việc ph�t hiện Y. enterocolitica g�y bệnh.
CH� TH�CH: Việc x�c nhận gi� trị sử dụng phải được thực hiện theo c�c phần th�ch hợp của TCVN (ISO 16140) (tất cả c�c phần). Việc kiểm tra x�c nhận c�c mẫu tổng hợp c� thể được thực hiện theo quy tr�nh n�u trong TCVN 6707-1 (ISO 6887-1), Phụ lục D (quy tr�nh kiểm tra x�c nhận đối với mẫu tổng hợp về thử nghiệm định t�nh).
10.1.3 �Chuẩn bị dung dịch huyền ph� ITC tăng sinh chọn lọc bằng c�ch chuyển 10 ml huyền ph� PSB (10.1.2) v�o 90 ml canh thang ITC (B.3) v� trộn.
10.2 �Cấy trực tiếp l�n đĩa thạch chọn lọc
Lấy 1 ml huyền ph� PSB ban đầu chưa tăng sinh thu được (10.1.2) v�o hai đến bốn thạch đĩa CIN (B.6) v� d�n đều tr�n c�c đĩa, sử dụng bộ d�n mẫu (7.6).
Lật ngược c�c đĩa CIN v� đặt ch�ng v�o tủ ấm ở 30 �C (7.2) trong 24 h � 2 h.
CH� TH�CH 1: Trước khi ủ, c� thể cần l�m kh� c�c thạch đĩa CIN (v� dụ: trong tủ cấy tho�ng kh�) trong nửa giờ để hấp thụ ho�n to�n dịch cấy v�o thạch.
CH� TH�CH 2: Số lượng thạch đĩa CIN cần sử dụng phụ thuộc v�o mức dự kiến về hệ vi khuẩn nền trong mẫu.
10.3 �Tăng sinh
Ủ huyền ph� ban đầu trong PSB (10.1.2) v� canh thang tăng sinh chọn lọc ITC (10.1.3) ở 25 �C (7.2) trong 44 h � 4 h (kh�ng khuấy trộn).
10.4 �Cấy đĩa v� ủ ấm
10.4.1 �Cấy l�n thạch đĩa CIN m�i trường tăng sinh PSB v� ITC đ� xử l� bằng KOH
D�ng pipet v� tr�ng (7.5) chuyển 0,5 ml m�i trường tăng sinh PSB (10.3) v�o 4,5 ml dung dịch kali hydroxit (B.5) (được chuẩn bị trong ng�y sử dụng) trộn đều[7]. Sau 20 s � 5 s bổ sung m�i trường tăng sinh PSB v�o dung dịch KOH, d�ng v�ng cấy (7.6) ria cấy l�n bề mặt thạch đĩa CIN (B.6) sao cho thu được c�c khuẩn lạc ri�ng rẽ. Lặp lại quy tr�nh với m�i trường tăng sinh ITC (10.3).
CH� TH�CH 1: Điều quan trọng đối với hiệu năng của phương ph�p l� chuẩn bị KOH trong ng�y, trước khi sử dụng, xem Phụ lục B v� Phụ lục C.
Lật �p c�c đĩa CIN v� đặt v�o tủ ấm ở 30 �C (7.2) trong 24 h � 2 h.
CH� TH�CH 2: Ngo�i ra, c� thể ria cấy [d�ng v�ng cấy (7.6)] c�c thạch đĩa CIN với PSB v� ITC chưa xử l� (kh�ng xử l� với KOH).
CH� TH�CH 3: Trong qu� tr�nh xử l� KOH, m�i trường tăng sinh được pha lo�ng 10 lần. Ngo�i ra, việc xử l� c� thể l�m giảm số lượng vi khuẩn g�y bệnh Y. enterocolitica trong dung dịch. Do đ�, trong một số trường hợp, c� thể ria cấy đĩa thạch CIN bổ sung 0,1 ml dịch cấy.
10.4.2 �Cấy l�n thạch sinh m�u m�i trường tăng sinh PSB v� ITC xử l� bằng KOH (t�y chọn)
Lặp lại quy tr�nh trong 10.4.1 v� nu�i cấy, sau khi xử l� KOH, sử dụng v�ng cấy (7.6), ria cấy l�n bề mặt của đĩa thạch sinh m�u [9,13,18] sao cho thu được c�c khuẩn lạc ri�ng rẽ.
Ủ c�c đĩa thạch sinh m�u theo hướng dẫn của nh� sản xuất.
10.5 �Nhận biết c�c khuẩn lạc điển h�nh
Sau khi ủ 24 h � 2 h, kiểm tra c�c đĩa CIN để ph�t hiện sự c� mặt c�c khuẩn lạc điển h�nh của Y. enterocolitica. N�n sử dụng k�nh hiển vi soi nổi (7.7) được trang bị đ�n chiếu s�ng truyền qua trường tối hoặc chếch một g�c 45�.
Tr�n thạch CIN, Y. enterocolitica g�y bệnh c� khuẩn lạc nhỏ (khoảng 1 mm hoặc nhỏ hơn), h�nh tr�n, bờ đều trơn nhẵn. C�c khuẩn lạc c� viền nhỏ m�u đỏ đậm, sắc n�t (�mắt b�) bao quanh. Viền bao quanh mờ hoặc đục v� khi kiểm tra với �nh s�ng truyền ch�o, c�c hạt nhỏ mịn v� kh�ng �ng �nh.
CH� TH�CH 1: �nh s�ng truyền qua trường tối hoặc xi�n g�c gi�p ph�n biệt c�c khuẩn lạc Yersinia enterocolitica điển h�nh so với c�c khuẩn lạc tương tự của c�c lo�i Yersinia kh�c [12] v� một số lo�i kh�ng phải Yersinia.
CH� TH�CH 2: Trong trường hợp hệ vi khuẩn nền mọc d�y đặc tr�n đĩa CIN, k�ch thước khuẩn lạc Y. enterocolitica g�y bệnh c� thể nhỏ hơn v� t�m đỏ điển h�nh c� thể kh�ng r� r�ng hoặc kh�ng c�.
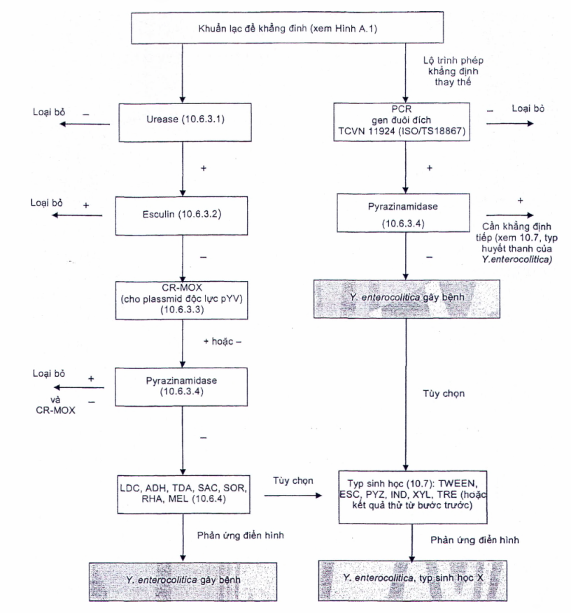
10.6 �Khẳng định
10.6.1 �Y�u cầu chung
Cần sử dụng c�c chủng kiểm chứng của c�c lo�i Yersinia đặc biệt l� để ph�n biệt giữa Yersinia enterocolitica g�y bệnh v� c�c lo�i Yersinia kh�c tr�n thạch CIN. Cần sử dụng c�c chủng kiểm chứng �m v� kiểm chứng dương th�ch hợp cho mỗi ph�p thử khẳng định. C�c v� dụ th�ch hợp về c�c chủng kiểm chứng được n�u trong c�c phần li�n quan với c�c ph�p kiểm chứng n�y. Sơ đồ khẳng định được n�u trong H�nh A.2.
10.6.2 �Chọn c�c khuẩn lạc để khẳng định
Để khẳng định, lấy từ mỗi đĩa c�c m�i trường chọn lọc (xem 10.3), năm khuẩn lạc được coi l� điển h�nh của Y. enterocolitica g�y bệnh nếu c� sẵn (xem 10.5).
Ria cấy c�c khuẩn lạc đ� chọn l�n bề mặt thạch đĩa CIN (B.6) sao cho c� c�c khuẩn lạc ri�ng rẽ. Đồng thời ria cấy c�c chủng Y. enterocolitica kiểm chứng typ huyết thanh sinh học (typ huyết thanh sinh học) 4/0:3; 2/0:9, typ sinh học 1A v� c�c lo�i Yersinia kh�c để so s�nh h�nh th�i khuẩn lạc.
Ngo�i ra, n�n ria cấy c�c khuẩn lạc điển h�nh để khẳng định v� c�c chủng kiểm chứng th�ch hợp tr�n thạch sinh m�u song song với ria cấy tr�n thạch CIN. Để nhận dạng c�c khuẩn lạc điển h�nh tr�n thạch sinh m�u, tiến h�nh theo hướng dẫn của nh� sản xuất về đ�nh gi� h�nh th�i điển h�nh của khuẩn lạc.
V� DỤ: C�c chủng Y. enterocolitica kiểm chứng ph� hợp l� WDCM 00216 (typ huyết thanh sinh học 4/0:3), WDCM 00215 (typ huyết thanh sinh học 2/0:9) v� WDCM 00160 (typ huyết thanh sinh học 1B/0:8).
Lật �p c�c đĩa v� đặt v�o tủ ấm c�i đặt ở nhiệt độ 30 �C (7.2) trong 24 h � 2 h.
Kiểm tra c�c đĩa đ� ủ c�c khuẩn lạc đặc trưng (xem 10.5) v� độ thuần khiết của chủng cấy. Điều n�y được thực hiện với sự trợ gi�p của k�nh hiển soi vi nổi (7.7). So s�nh h�nh th�i của c�c khuẩn lạc nghi ngờ với c�c khuẩn lạc của c�c chủng kiểm chứng để ph�n biệt r� hơn giữa c�c khuẩn lạc điển h�nh v� kh�ng điển h�nh. Loại bỏ c�c đĩa c� c�c khuẩn lạc kh�ng điển h�nh. Nếu tr�n đĩa c� khuẩn lạc điển h�nh v� kh�ng điển h�nh th� cấy truyền c�c khuẩn lạc điển h�nh l�n c�c thạch đĩa CIN (B.6) v� ủ như tr�n.
Tiến h�nh với một đĩa cấy thuần đại diện cho c�c khuẩn lạc điển h�nh ban đầu tr�n đĩa gốc. Giữ lại đĩa cấy c�c khuẩn lạc thuần điển h�nh kh�c (đến năm đĩa khuẩn lạc, nếu c�) để khẳng định trong trường hợp đĩa cấy đầu ti�n kh�ng khẳng định được. Ria cấy c�c khuẩn lạc đ� chọn l�n bề mặt thạch kh�ng chọn lọc (v� dụ: thạch dinh dưỡng (B.7), thạch m�u hoặc thạch trypton đậu tương) sao cho thu được c�c khuẩn lạc ri�ng rẽ.
Lật �p c�c đĩa đ� cấy v� đặt v�o tủ ấm ở 30 �C (7.2) trong 18 h đến 24 h hoặc cho đến khi khuẩn lạc ph�t triển tốt.
Sử dụng c�c chủng cấy thuần để khẳng định sinh h�a v� để thử nghiệm t�nh g�y bệnh.
CH� TH�CH 1: Kh�ng bắt buộc phải khẳng định từ tất cả c�c bước tăng sinh tiếp theo nếu Y. enterocolitica g�y bệnh đ� được khẳng định ngay từ bước đầu.
CH� TH�CH 2: Đối với c�c mục đ�ch dịch tễ học hoặc trong qu� tr�nh điều tra dịch bệnh th� việc khẳng định c�c khuẩn lạc bổ sung, v� dụ: năm khuẩn lạc điển h�nh hoặc nghi ngờ từ mỗi m�i trường tăng sinh chọn lọc/kết hợp m�i trường ph�n lập, c� thể c� �ch.
10.6.3 �X�c định c�c lo�i Yersinia g�y bệnh
10.6.3.1 �Ph�t hiện urease
Ria cấy c�c khuẩn lạc l�n bề mặt nghi�ng của thạch (B.10). Nới lỏng nắp ống nghiệm sao cho kh�ng kh� c� thể đi v�o v� tạo điều kiện ph�t triển hiếu kh�.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
M�u hồng t�m hoặc đỏ hồng l� phản ứng urease dương t�nh.
V� dụ: Chủng kiểm chứng dương t�nh ph� hợp l� WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 00160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8).
M�u v�ng-cam l� phản ứng urease �m t�nh.
Giữ lại tất cả c�c khuẩn lạc urease dương t�nh v� c� h�nh th�i khuẩn lạc điển h�nh để khẳng định th�m.
CH� TH�CH 1: C�c chủng Y. enterocolitica g�y bệnh được cấy tr�n một số loại thạch ur� c� b�n sẵn c� thể cần th�m thời gian (l�n đến 7 ng�y) để cho phản dương t�nh.
CH� TH�CH 2: Cũng c� c�c chủng Y. enterocolitica g�y bệnh cho phản ứng urease �m t�nh, nhưng rất hiếm (0,01 %).
10.6.3.2 �Thủy ph�n esculin
Ria cấy vi khuẩn tr�n bề mặt thạch nghi�ng (B.12).
Ủ ấm ở 30 �C (7.2) trong 24 h � 2 h.
Sau khi ủ thấy c� quầng đen quanh c�c khuẩn lạc chứng tỏ phản ứng dương t�nh.
V� DỤ: Chủng kiểm chứng �m th�ch hợp l� WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8) v� chủng kiểm chứng dương l� bất kỳ chủng Y. enterocolitica n�o c� typ sinh học 1A điển h�nh hoặc Y. intermedia WDCM 00217.
CH� TH�CH: Ph�p thử thủy ph�n esculin n�y tương đương với ph�p thử l�n men salicin trong việc x�c định khả năng g�y bệnh.
10.6.3.3 �Ph�t hiện plasmid độc lực (pYV) bằng ph�p thử tr�n thạch CR-MOX
Y.enterocolitica g�y bệnh li�n kết với đỏ Congo để h�nh th�nh c�c khuẩn lạc nhỏ như đầu đinh ghim (pin-point) điển h�nh ở 37 �C. Plasmid độc lực (pYV) x�c định c�c đặc điểm li�n quan đến khả năng g�y bệnh của Yersinia v� nhiều trong số đ�, kể cả sự ph�t triển phụ thuộc v�o canxi chỉ ở 37 �C.
Plasmid độc lực (pYV) c� thể tự m�t đi trong qu� tr�nh bảo quản tại ph�ng thử nghiệm, khi nu�i cấy l�u d�i v� c�c bước lặp lại. Do đ�, ph�p thử kiểm tra plasmid độc (thử nghiệm CR-MOX) phải được thực hiện ở giai đoạn khẳng định sớm.
Sử dụng v�ng cấy (7.6) lấy v�i khuẩn lạc của chủng cấy thuần đ� chọn để khẳng định tiếp (urease dương t�nh, h�nh th�i của khuẩn lạc điển h�nh). Cấy v�o bề mặt thạch CR-MOX (B.11) sao cho thu được c�c khuẩn lạc ri�ng rẽ.
Ủ ấm ở 37 �C (7.2) trong khoảng từ 24 h đến 48 h.
Nếu cần, kiểm tra c�c đĩa dương t�nh c� chứa khuẩn lạc pYV sau 24 h v� ủ tiếp 24 h nữa, nếu chưa thấy c� khuẩn lạc dương t�nh.
Đĩa cho phản ứng dương t�nh c� chứa c�c khuẩn lạc nhỏ như đầu đinh ghim (li�n kết đỏ congo) sắc tố cam đỏ r� n�t (ph�t triển phụ thuộc v�o canxi ở 37 �C) v� c� thể l� c�c khuẩn lạc lớn hơn kh�ng m�u. Đĩa cho phản ứng �m t�nh chỉ chứa c�c khuẩn lạc kh�ng m�u.
CH� TH�CH 1: Trong dịch cấy thuần, th�ng thường một số khuẩn lạc c� chứa c�c tế b�o mang plasmid độc lực pYV, trong khi c�c khuẩn lạc kh�c trong c�ng mẻ cấy lại chứa c�c tế b�o kh�ng mang plasmid. Khi chuẩn bị dịch cấy cho thử nghiệm n�y, d�ng que cấy lấy v�i khuẩn lạc để tr�nh chỉ chọn phải c�c tế b�o vi khuẩn kh�ng mang plasmid.
CH� TH�CH 2: Để ph�n biệt r� hơn giữa c�c phản ứng dương t�nh v� �m t�nh, tốt nhất l� cấy song song hai đĩa CR-MOX từ c�ng một chủng cấy thử nghiệm v� ủ một đĩa ở 37 �C (7.2) v� một đĩa ở 25 �C (7.2 ). Đĩa ủ ở 25 �C (7.2) lu�n cho phản ứng �m t�nh (ngay cả khi ch�ng đ� c� chứa pYV). Do đ�, c� thể quan s�t r� sự kh�c nhau giữa kết quả dương t�nh được chứng nhận ở 37 �C (7.2) v� phản ứng �m t�nh ở 25 �C (7.2).
Kiểm chứng dương th�ch hợp l� bất kỳ chủng Y. enterocolitica g�y bệnh n�o đ� được kiểm tra x�c nhận mang plasmid độc, trước khi sử dụng.
V� DỤ: Chủng kiểm chứng dương th�ch hợp l� WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) v� chủng kiểm chứng �m l� WDCM 00160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8, plasmid tự do) hoặc WDCM 00217 (Y. intermedia).
V� plasmid độc lực (pYV) c� thể bị mất đi trong qu� tr�nh nu�i cấy truyền trong ph�ng thử nghiệm, n�n cần tiếp tục khẳng định với c�c chủng cho phản ứng �m t�nh trong ph�p thử.
Ngo�i ra, cần bảo quản c�c chủng dương bằng c�ch đ�ng lạnh chủng cấy gốc ở giai đoạn đầu của qu� tr�nh khẳng định [tốt nhất l� sau khi c� phản ứng urease dương t�nh (10.6.3.1) v� ph�p thử CR-MOX (10.6.3.3)].
V� dụ về bảo quản c�c chủng được n�u dưới đ�y (c� thể d�ng c�c phương ph�p bảo quản dịch cấy th�ch hợp kh�c):
- cấy truyền ngay từng dịch cấy thuần v�o TSB (B.8):
- ủ ở 30 �C (7.2) trong 24 h � 2 h;
- th�m một thể t�ch tương đương của glycerol 40 % v� tr�ng (B.9) để c� được nồng độ glycerol cuối c�ng l� 20 %;
- trộn đều v� cấp đ�ng, tốt nhất ở -70 �C.
10.6.3.4 �Ph�t hiện pyrazinamidase
Cấy một v�ng cấy (7.6) đầy c�c khuẩn lạc l�n hết mặt thạch nghi�ng (B.13) của m�i trường. Ủ ở 30 �C (7.2) trong 48 h � 4 h.
Th�m 1 ml dung dịch sắt(II) amoni sulfat 1 % (B.14) mới chuẩn bị (trong ng�y sử dụng).
Nếu phản ứng dương t�nh, xuất hiện m�u n�u hồng trong v�ng 15 min cho thấy sự c� mặt axit pyrazinoic được h�nh th�nh do enzym pyrazinamidase.
V� DỤ: Chủng kiểm chứng �m th�ch hợp l� WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8) v� chủng kiểm chứng dương l� bất kỳ chủng Y. enterocolitica c� typ sinh học 1A điển h�nh n�o hoặc Y. intermedia WDCM 00217.
CH� TH�CH: Khả năng c�c phản ứng dương t�nh giả tăng nếu sử dụng dung dịch sắt(II) amoni sulfat 1 % đ� chuẩn bị l�u ng�y.
10.6.3.5 �Ph�t hiện pyrazinamidase
Chủng cấy Yersinia g�y bệnh nếu cho phản ứng urease dương t�nh, esculin v� pyrazinamidase �m t�nh. Ngo�i ra, sự c� mặt của plasmid độc lực pYV (10.6.3.3) l� một dấu hiệu chắc chắn về khả năng g�y bệnh [10,14]. Để khẳng định Y. enterocolitica g�y bệnh, tiến h�nh theo 10.6.4.
10.6.4 �Khẳng định Y. enterocolitica g�y bệnh
10.6.4.1 �Y�u cầu chung
Sau khi x�c định Yersinia g�y bệnh tiến h�nh khẳng định Y. enterocolitica. Điều n�y chỉ cần nếu ph�p thử trong 10.6.3 cho thấy sự c� mặt của lo�i Yersinia g�y bệnh.
10.6.4.2 �Lysin decarboxylase v� arginin dihydrolase
D�ng que cấy (7.6) cấy vi khuẩn v�o từng m�i trường lỏng ở ngay dưới bề mặt (B.15). Nếu ống kh�ng đầy m�i trường v� kh�ng k�n kh� th� phủ bề mặt bằng dầu Vaselin�2) n�ng chảy (được gia nhiệt sau đ� l�m nguội ngay sao cho vẫn giữ ở dạng lỏng) hoặc paraffin dạng lỏng v� tr�ng.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
M�i trường c� m�u t�m sau khi ủ l� phản ứng dương t�nh.
M�i trường c� m�u v�ng l� phản ứng �m t�nh.
10.6.4.3 �Phenylalanin (tryptophan) deaminase
Cấy vi khuẩn l�n một khoảng rộng của bề mặt thạch nghi�ng (B.16) của m�i trường.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
Nhỏ 2 giọt đến 3 giọt dung dịch sắt (III) clorua 10 % (B.17) l�n khuẩn lạc mọc tr�n bề mặt thạch nghi�ng.
Nếu thấy c� m�u xanh l� phản ứng dương t�nh.
10.6.4.4 �L�n men sucrose, sorbitol, rhamnose v� melibiose
Cấy vi khuẩn v�o từng m�i trường (B.18) ngay dưới bề mặt chất lỏng.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
M�i trường c� m�u v�ng sau khi ủ l� phản ứng dương t�nh.
M�i trường c� m�u đỏ l� phản ứng �m t�nh.
10.6.4.5 �Sử dụng citrat (Simmon's citrate) (t�y chọn)
D�ng que cấy (7.6) lấy một khuẩn lạc ri�ng rẽ của một chủng được thử nghiệm v� trộn kỹ với một giọt dung dịch muối (B.4).
CH� TH�CH 1: Bước rửa bằng muối loại bỏ chất dinh dưỡng dư thừa từ m�i trường cấy v� hỗ trợ để tr�nh cho kết quả dương t�nh giả v� giải quyết sự cố. Việc ủ qu� l�u c� thể cũng g�y ra phản ứng dương t�nh giả.
CH� TH�CH 2: Ph�p thử c� thể cho phản ứng dương t�nh giả trong một số k�t thử nhận biết sinh h�a c� b�n sẵn.
Cấy huyền ph� l�n thạch (B.19) v� ủ ở 30 �C (7.2) trong 24 � 2 h.
Phản ứng dương t�nh nếu c� vi khuẩn mọc v� m�i trường chuyển m�u xanh. Phản ứng c� m�u xanh mờ cũng được coi l� dương t�nh.
V� DỤ: Chủng kiểm chứng dương ph� hợp l� Y. intermedia WDCM 00217 (kiểm chứng dương) v� Y. enterocolitica WDCM 00216 (typ huyết thanh sinh học 4/0:3, kiểm chứng �m) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8, kiểm chứng �m).
CH� TH�CH 3: Ph�p thử n�y c� �ch trong việc ph�n biệt giữa Y. enterocolitica (phản ứng �m t�nh) v� nhiều lo�i c� li�n quan như Y. intermedia, Y. frederiksenii, Y. rohdei v� Y. aldovae (phản ứng dương t�nh v� phản ứng thay đổi).
10.6.4.6 �C�c ph�p thử khẳng định thay thế
Trong ph�p thử khẳng định khả năng g�y bệnh của Y. enterocolitica, c� thể thay c�c ph�p thử sinh h�a 10.6.3 v� 10.6.4 bằng ph�p thử PCR real-time nhằm v�o gen-ail theo TCVN 11924 (ISO/TS 18867) (xem H�nh A.2 v� T�i liệu tham khảo [6]). Tuy nhi�n, trong trường hợp phản ứng PCR real-time dương t�nh th� bắt buộc phải tiến h�nh ph�t hiện pyrazinamidase (10.6.3.4) để thu được kết quả thử nghiệm theo ti�u chuẩn n�y.
Nếu được chứng minh l� đ�ng tin cậy, c� thể sử dụng c�c bộ sưu tập thu nhỏ để nhận dạng sinh h�a của Y. enterocolitica [xem TCVN 6404 (ISO 7218)]. C�c bộ sưu tập n�y tối thiểu phải bao gồm c�c ph�p thử sinh h�a được quy định trong ti�u chuẩn n�y.
CH� TH�CH 1: C� thể d�ng c�c quy tr�nh thay thế để khẳng định chủng ph�n lập l� Y. enterocolitica, cung cấp t�nh ph� hợp của c�c quy tr�nh thay thế đ� được kiểm tra x�c nhận [xem TCVN 6404 (ISO 7218)].
CH� TH�CH 2: Một số quy tr�nh nhận biết thay thế c� thể x�c định kh�ng ch�nh x�c lo�i gần nhất của c�c lo�i Yersinia l� Y. enterocolitica.
10.6.5 �Diễn giải kết quả của c�c ph�p thử khẳng định Y. enterocolitica
Y. enterocolitica cho c�c kết quả theo Bảng 1.
Bảng 1 - Diễn giải kết quả c�c ph�p thử khẳng định đối với Yersinia enterocolitica
| Ph�p thử | Phản ứng |
| Ure (10.6.3.1) |
|
| Lysin decarboxylase (10.6.4.2) | - |
| Arginin dihydrolase (10.6.4.2) |
|
| Phenylalanin/Tryptophan deaminase (10.6.4.3) | - |
| Sucrose (10.6.4.4) | a |
| Sorbitol (10.6.4.4) | a |
| Rhamnose (10.6.4.4) | - |
| Melibiose (10.6.4.4) | - |
| Xitrat (10.6.4.5) | - |
| a C� thể gặp c�c chủng �m t�nh thuộc typ sinh học g�y bệnh. | |
10.6.6 �Diễn giải c�c kết quả thử khẳng định đối với Y. enterocolitica g�y bệnh
Y. enterocolitica g�y bệnh được ph�t hiện nếu c� �t nhất một khuẩn lạc urease dương t�nh v� esculin v� pyrazinamidase �m t�nh (10.6.3.5) v� thể hiện c�c đặc t�nh của Y. enterocolitica n�u trong Bảng 1 (10.6.5).
Đối với việc diễn giải kết quả của PCR real-time (khẳng định lựa chọn thay thế), xem Phụ lục A, H�nh A.2 v� TCVN 11924 (ISO/TS 18867).
10.7 �Đ�nh gl� typ sinh học của Y. enterocolitica (t�y chọn)
10.7.1 �Y�u cầu chung
Ngo�i c�c ph�p thử esculin (10.6.3.2) v� pyrazinamidase (10.6.3.4), qu� tr�nh đ�nh gi� typ sinh học ho�n chỉnh bao gồm c�c ph�p thử xylose, tween-esterase/lipase, salicin (t�y chọn), trehalose v� indole.
Sử dụng c�c chủng kiểm chứng th�ch hợp cho mỗi lần thử trong đ�nh gi� typ sinh học.
V� DỤ: Chủng kiểm chứng dương t�nh th�ch hợp cho tất cả c�c ph�p thử l� bất kỳ chủng Y. enterocolitica n�o c� typ sinh học 1A điển h�nh. Y. enterocolitica WDCM 000160 (typ sinh học 1B/0:8) ph� hợp cho kiểm chứng dương đối với tất cả c�c ph�p thử kh�c (10.7.1 đến 10.7.4) trừ ph�p thử salicin (10.7.3). Y. intermedia WDCM 00217 th�ch hợp l�m kiểm chứng dương t�nh cho tất cả c�c ph�p thử kh�c (10.7.1 đến 10.7.4) trừ ph�p thử tween-esterase (10.7.2). Một v� dụ kh�c về chủng kiểm chứng �m th�ch hợp cho c�c ph�p thử xylose (10.7.1), tween-esterase (10.7.2), salicin (10.7.3) v� indole (10.7.4) l� WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3).
10.7.2 �L�n men xylose
Cấy vi khuẩn v�o m�i trường (B.18) ngay dưới bề mặt của chất lỏng.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
M�i trường c� m�u v�ng sau khi ủ l� phản ứng dương t�nh.
M�i trường c� m�u đỏ l� phản ứng �m t�nh.
10.7.3 �Ph�p thử tween-esterase
Ria cấy vi khuẩn l�n bề mặt của đĩa thạch (B.20).
Ủ ở 25 �C (7.2) trong 44 h � 4 h.
Phản ứng l� dương t�nh nếu xuất hiện quầng mờ đục kết tủa (do c�c tinh thể canxi oleate).
CH� TH�CH: Một số chủng Y. enterocolitica c� khả năng g�y bệnh điển h�nh typ sinh học 1B c� thể cho phản ứng dương t�nh chậm hoặc yếu trong thử nghiệm tween-esterase. Phản ứng dương t�nh của ch�ng c� thể quan s�t tốt hơn trong m�i trường thạch l�ng đỏ trứng (ph�p thử lipase) [11].
10.7.4 �L�n men salicin (t�y chọn) v� trehalose
Cấy vi khuẩn v�o từng m�i trường (B.18) ngay dưới bề mặt của chất lỏng.
Ủ ở 30 �C (7.2) trong 24 h � 2 h.
M�i trường c� m�u v�ng sau khi ủ l� phản ứng dương t�nh.
M�i trường c� m�u đỏ l� phản ứng �m t�nh.
10.7.5 �H�nh th�nh indole
Cấy vi khuẩn v�o ống m�i trường trypton/tryptophan (B.21). Sử dụng �t nhất năm khuẩn lạc để nu�i cấy.
Ủ ở 30 �C (7.2) trong 48 h � 4 h.
Nhỏ 1 ml thuốc thử Kovac (B.22) v� để ở nhiệt độ ph�ng từ 10 min đến 15 min.
M�i trường c� m�u đỏ l� phản ứng dương t�nh.
M�i trường c� m�u v�ng/n�u l� phản ứng �m t�nh.
10.7.6 �Diễn giải thử nghiệm typ sinh học
Dựa v�o ph�p thử esculin (10.6.3.2), pyrazinamidase (10.6.3.4) v� c�c ph�p thử xylose, tween-esterase (lipase), trehalose v� indole (10.7.2 đến 10.7.5). C�c chủng Y. enterocolitica c� thể được chia th�nh c�c typ sinh học (Bảng 2). Theo c�c phản ứng của ph�p thử, c�c chủng Y. enterocolitica được coi l� g�y bệnh nếu ch�ng thuộc c�c typ sinh học 1B, 2, 3, 4 hoặc 5. C� thể thực hiện c�c ph�p thử sinh h�a bổ sung.
Đối với mục đ�ch dịch tễ học, cần x�c định c�c kh�ng nguy�n somatic của Y. enterocolitica. C�c chủng g�y bệnh c� typ huyết thanh thường gặp l� c�c typ huyết thanh 0:3, 0:8, 0:9 hoặc 0:5,27 khi sử dụng kh�ng huyết thanh th�ch hợp.
Nếu c�c ph�p thử esculin, xylose v� pyrazinamidase cho phản ứng �m t�nh th� kết quả cho thấy typ sinh học 4. Điều n�y c� thể được khẳng định bằng c�ch x�c định typ huyết thanh v� typ huyết thanh sinh học 4/0:3 chiếm tỷ lệ cao nhất ở nhiều quốc gia [8].
Bảng 2 - C�c typ huyết thanh của Yersinia enterocolitica
| Phản ứng | Typ huyết thanha | |||||
| 1Ab | 1B | 2 | 3 | 4 | 5 | |
| Esculin/Salicin |
| - | - | - | - | - |
| Xylose |
|
|
|
| - | Dd |
| Pyrazinamidase |
| - | - | - | - | - |
| Tween-esterase/Lipase |
| c | - | - | - | - |
| Trehalose |
|
|
|
|
| - |
| Indole |
|
|
| - | - | - |
| a C�c chủng thuộc typ sinh học 1B, 2, 3, 4 v� 5 chứa c�c plasmid độc lực pYV (10.6.3.3) m� c� thể mất đi trong qu� tr�nh cấy truyền trong ph�ng thử nghiệm. b Thường được coi l� kh�ng g�y bệnh. Tuy nhi�n, c� c�c chỉ thị cho thấy một tỷ lệ nhỏ của c�c chủng 1A c� thể g�y bệnh [16]. c Phản ứng tween-esterase c� thể yếu hoặc chậm (xem 10.7.3). d D: thường yếu hoặc chậm. | ||||||
11 �Biểu thị kết quả
Theo diễn giải kết quả cho thấy Yersinia enterocolitica g�y bệnh được ph�t hiện hoặc kh�ng ph�t hiện c� trong phần mẫu thử x g hoặc x ml sản phẩm [xem TCVN 6404 (ISO 7218)], hoặc tr�n một diện t�ch bề mặt hoặc trong tăm b�ng.
12 �Đặc t�nh hiệu năng của phương ph�p
12.1 �Nghi�n cứu li�n ph�ng
C�c đặc t�nh hiệu năng của phương ph�p được x�c định trong một nghi�n cứu li�n ph�ng (hoặc c�c nghi�n cứu) để x�c định độ đặc hiệu, độ đ�p ứng v� LOD50 của phương ph�p. Dữ liệu được thống k� trong Phụ lục C. C�c gi� trị thu được từ nghi�n cứu li�n ph�ng n�y c� thể kh�ng �p dụng được cho c�c loại thực phẩm kh�c với c�c loại thực phẩm n�u trong Phụ lục C.
12.2 �Độ đ�p ứng
Độ đ�p ứng được x�c định l� số mẫu dương t�nh t�m thấy được chia cho số mẫu dương t�nh thực được thử nghiệm ở mức nhiễm đ� n�u. Do đ�, c�c kết quả phụ thuộc v�o mức nhiễm của mẫu.
12.3 �Độ đặc hiệu
Độ đặc hiệu được x�c định l� số mẫu �m t�nh t�m thấy được chia cho số lượng mẫu �m t�nh thực (hoặc mẫu trắng) được thử nghiệm.
12.4 �LOD50
LOD50 l� nồng độ (cfu/mẫu) m� x�c suất ph�t hiện l� 50 %.
13 �B�o c�o kết quả thử nghiệm
B�o c�o thử nghiệm phải ghi r�:
- phương ph�p thử đ� sử dụng, viện dẫn ti�u chuẩn n�y;
- phương ph�p lấy mẫu đ� sử dụng, nếu biết;
- cỡ phần mẫu thử v�/hoặc bản chất của mẫu được kiểm tra;
- mọi chi tiết thao t�c kh�ng quy định trong ti�u chuẩn n�y, hoặc t�y chọn c�ng với c�c chi tiết bất thường kh�c c� thể ảnh hưởng tới kết quả;
- mọi thay đổi về m�i trường hoặc điều kiện ủ được sử dụng;
- mọi th�ng tin cần thiết để nhận biết đầy đủ về mẫu thử;
- c�c kết quả thử nghiệm thu được;
- ng�y thử nghiệm.
B�o c�o kết quả cũng phải n�u r� nếu c�c ph�p thử tiếp theo phải được hoặc đ� được thực hiện trong ph�ng thử nghiệm chuẩn, nếu sẵn c� th� n�u c�c kết quả thu được.
14 �Bảo đảm chất lượng
Ph�ng thử nghiệm phải c� một hệ thống kiểm so�t chất lượng được x�c định r� r�ng để đảm bảo rằng thiết bị, thuốc thử v� kỹ thuật th�ch hợp cho c�c ph�p thử. Việc sử dụng c�c kiểm chứng dương t�nh, kiểm chứng �m t�nh v� mẫu trắng l� một phần của ph�p thử. Việc kiểm tra hiệu năng của m�i trường nu�i cấy được quy định trong B.23 v� trong TCVN 8128 (ISO 11133)].
Phụ lục A
(Quy định)
H�nh A.1 - Sơ đồ quy tr�nh ph�t hiện Y. enterocolitica g�y bệnh trong c�c mẫu thực phẩm, thức ăn chăn nu�i v� m�i trường
CH� TH�CH: PCR real-time gen đu�i đ�ch c� thể được sử dụng để s�ng lọc mẫu dương trong canh thang PSB sau khi ủ 24 h � 2h ở 25 �C (7.2). Xem TCVN 11924 (ISO/TS 18867) về quy tr�nh chi tiết.
H�nh A.2 - Sơ đồ khẳng định Y. enterocolitica g�y bệnh
(Quy định)
Th�nh phần v� c�ch chuẩn bị m�i trường nu�i cấy v� thuốc thử
B.1 �Y�u cầu chung
C�c quy định chung của TCVN 8128 (ISO 11133) c� thể �p dụng để chuẩn bị v� kiểm tra hiệu năng của m�i trường nu�i cấy n�u trong phụ lục n�y. Nếu m�i trường nu�i cấy hoặc thuốc thử được chuẩn bị từ c�c m�i trường/thuốc thử ho�n chỉnh kh� hoặc sử dụng c�c m�i trường/thuốc thử b�n sẵn để sử dụng, th� thực hiện theo hướng dẫn của nh� sản xuất về việc chuẩn bị, điều kiện bảo quản, hạn sử dụng v� c�ch sử dụng.
Thời hạn sử dụng của c�c m�i trường được n�u trong phụ lục n�y đ� được n�u trong một số nghi�n cứu. Người sử dụng phải x�c nhận lại hạn sử dụng trong điều kiện bảo quản của m�nh [xem TCVN 8128 (ISO 11133)].
Thử nghiệm hiệu năng về đảm bảo chất lượng của m�i trường nu�i cấy được n�u trong B.23.
B.2 �Canh thang pepton, sorbitol v� muối mật (PSB)
B.2.1 �Th�nh phần
| Sản phẩm thủy ph�n casein bằng enzym | 5,0 g |
| Sorbitol | 10,0 g |
| Natri clorua | 5,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 8,23 g |
| Natri dihydro phosphat ngậm một ph�n tử nước (NaH2PO4.H2O) | 1,2 g |
| Muối mật | 1,5 g |
| Nước | 1 000 ml |
B.2.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun n�ng nếu cần. Chỉnh pH để sau khi khử tr�ng, pH l� 7,6 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường v�o c�c ống nghiệm hoặc b�nh (7.3) c� dung t�ch th�ch hợp cho c�c mẫu thử (xem 10.1.2).
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.3 �Canh thang Irgasan�, ticarcillin v� kali clorat (ITC); canh thang triclosan, ticarcillin clorat (TTC)
B.3.1 �M�i trường cơ bản
B.3.1.1 �Th�nh phần
| Sản phẩm thủy ph�n casein bằng enzym | 10,0 g |
| Chất chiết nấm men | 1,0 g |
| Magie clorua ngậm s�u ph�n tử nước (MgCl2.6H2O) | 60,0 g |
| Natri clorua (NaCl) | 5,0 g |
| Xanh lục malachit, dung dịch 0,2 % | 5,0 ml |
| Nước | 1 000 ml |
B.3.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường cơ bản kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 6,9 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường cơ bản v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp để thu được c�c lượng cần thiết (v� dụ: 988 ml đối với 1 l m�i trường ho�n chỉnh).
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.3.2 �Dung dịch Ticarcillin (1 mg/ml)
B.2.2.1 �Th�nh phần
| Ticarcillin | 10,0 mg |
| Nước | 10 ml |
B.3.2.2 �Chuẩn bị
H�a tan ticarcillin trong nước. Lọc để khử tr�ng.
B.3.3 �Dung dịch triclosan (Irasan�) [5-clo-2-(2,4-diclorophenoxy)phenol] trong etanol (1 mg/ml)
B.3.3.1 �Th�nh phần
| Triclosan | 10,0 mg |
| Etanol, 95 % (thể t�ch) | 10,0 ml |
B.3.3.2 �Chuẩn bị
H�a tan triclosan trong etanol khi cần d�ng hoặc dung dịch n�y được bảo quản ở khoảng -20 �C trong kh�ng qu� 4 tuần.
B.3.4 �Dung dịch kali clorat (100 mg/ml)
B.3.4.1 �Th�nh phần
| Kali clorat (KClO3) | 10,0 g |
| Nước | 100 ml |
B.3.4.2 �Chuẩn bị
H�a tan kali clorat trong nước. Lọc để khử tr�ng.
B.3.5 �M�i trường ho�n chỉnh
B.3.5.1 �Th�nh phần
| M�i trường cơ bản (B.3.1) | 988 ml |
| Dung dịch ticarcillin (B.3.2) | 1 ml |
| Dung dịch triclosan (B.3.3) | 1 ml |
| Dung dịch kali clorat (B.3.4) | 10 ml |
B.3.5.2 �Chuẩn bị
Cho ticarcillin, triclosan v� dung dịch kali clorat một c�ch v� tr�ng v�o m�i trường cơ bản đ� được l�m nguội đến 47 �C v� trộn đều.
Ph�n phối 90 ml m�i trường n�y một c�ch v� tr�ng v�o c�c b�nh cầu c� dung t�ch th�ch hợp (xem 10.1.3), sao cho thu được tỷ lệ diện t�ch/thể t�ch l� tối thiểu (kỵ kh� tương đối).
B.4 �Dung dịch muối
B.4.1 �Th�nh phần
| Natri clorua (NaCl) | 9,0 g |
| Nước | 1 000 ml |
B.4.2 �Chuẩn bị
H�a tan natri clorua trong nước.
Ph�n phối dung dịch v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.5 �Kali hydroxit (KOH) trong dung dịch muối
B.5.1 �Th�nh phần
| Kali hydroxit (KOH) | 0,5 g |
| Dung dịch muối v� tr�ng (0,9 % NaCl, xem B.2) | 100 ml |
B.5.2 �Chuẩn bị
H�a tan kali hydroxit trong dung dịch muối v� tr�ng.
Ph�n phối dung dịch v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp.
Chuẩn bị dung dịch KOH trong ng�y sử dụng.
B.6 �Thạch cefsulodin, Irgasan� (triclosan) v� novobioxin (CIN)
B.6.1 �M�i trường cơ bản
B.6.1.1 �Th�nh phần
| Sản phẩm thủy ph�n gelatin bằng enzym | 17,0 g |
| Sản phẩm thủy ph�n casein v� m� động vật bằng enzym | 3,0 g |
| Chất chiết nấm men | 2,0 g |
| Manitol | 20,0 g |
| Natri pyruvat | 2,0 g |
| Natri clorua | 1,0 g |
| Magie sulfat ngậm bảy ph�n tử nước (MgSO4.7H2O) | 0,01 g |
| Natri desoxycholat | 0,5 g |
| Đỏ trung t�nh | 0,03 g |
| T�m tinh thể | 0,001 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.6.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường cơ bản kh� trong nước bằng c�ch đun n�ng.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,4 � 0,2 ở 25 �C nếu cần.
Ph�n phối m�i trường v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp để thu được c�c phần cần thiết (v� dụ: 997 ml cho 1 l�t m�i trường ho�n chỉnh).
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.6.2 �Dung dịch cefsulodin (15 mg/ml)
B.6.2.1 �Th�nh phần
| Cefsulodin | 1,5 g |
| Nước | 100 ml |
B.6.2.2 �Chuẩn bị
H�a tan cefsulodin trong nước. Lọc để khử tr�ng.
B.6.3 �Dung dịch Triclosan (Igrasan�) [5-cloro-2-(2,4-diclorophenoxy)phenol] trong etanol (4 mg/ml)
B.6.3.1 �Th�nh phần
| Triclosan | 0,4 g |
| Etanol, 95 % (thể t�ch) | 100 ml |
B.6.3.2 �Chuẩn bị
H�a tan triclosan trong etanol khi cần d�ng hoặc dung dịch n�y được bảo quản ở khoảng - 20 �C trong kh�ng qu� 4 tuần.
B.6.4 �Dung dịch novobiocin (2,5 mg/ml)
B.6.4.1 �Th�nh phần
| Novobiocin | 0,25 g |
| Nước | 100 ml |
B.6.4.2 �Chuẩn bị
H�a tan novobiocin trong nước. Lọc để khử tr�ng.
B.6.5 �M�i trường ho�n chỉnh
B.6.5.1 �Th�nh phần
| M�i trường cơ bản (B.6.1) | 997 ml |
| Dung dịch cefsulodin (B.6.2) | 1 ml |
| Dung dịch Triclosan (B.6.3) | 1 ml |
| Dung dịch novobiocin (B.6.4) | 1 ml |
B.6.5.2 �Chuẩn bị
Cho từng dung dịch kh�ng sinh n�y một c�ch v� tr�ng v�o m�i trường cơ bản đ� được l�m nguội đến khoảng 45 �C v� trộn đều.
B.6.5.3 �Chuẩn bị c�c thạch đĩa CIN
R�t khoảng 15 ml m�i trường ho�n chỉnh v�o c�c đĩa Petri v� tr�ng (7.4). Để y�n c�c đĩa.
B.7 �Thạch dinh dưỡng (v� dụ về m�i trường kh�ng chọn lọc)
B.7.1 �Th�nh phần
| Chất chiết thịt | 3,0 g |
| Pepton | 5,0 g |
| Natri clorua (NaCl) (t�y chọn) | 5,0 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
a T�y thuộc v�o sức đ�ng của thạch.
B.7.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun s�i.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,0 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.7.3 �Chuẩn bị c�c đĩa thạch dinh dưỡng
R�t khoảng 15 ml m�i trường đ� l�m nguội đến khoảng 45 �C v�o c�c đĩa Petri v� tr�ng (7.3). Để y�n c�c dĩa.
B.8 �Canh thang đậu tương tryptic (TSB) (canh thang đậu tương trypton, m�i trường thủy ph�n casein đậu tương)
B.8.1 �Th�nh phần
| Sản phẩm thủy ph�n casein bằng enzym | 17,0 g |
| Sản phẩm thủy ph�n đậu tương bằng enzym | 3,0 g |
| Natri clorua | 5,0 g |
| Dikali hydro phosphat | 2,5 g |
| Glucose (= Dextrose) | 2,5 g |
| Nước | 1 000 ml |
B.8.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun s�i, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,3 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường với c�c lượng 10 ml v�o c�c ống nghiệm (7.3).
Khử tr�ng 15 min trong nồi hấp �p lực ở nhiệt độ 121 � C.
B.9 �Glycerol v� tr�ng
Ph�n phối 100 ml glycerol v�o c�c ống nghiệm hoặc b�nh cầu (7.3) v� khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.10 �Thạch ure (Christensen)
B.10.1 �M�i trường cơ bản
B.10.1.1 �Th�nh phần
| Pepton | 1,0 g |
| Glucose | 1,0 g |
| Natri clorua | 5,0 g |
| Kali dihydro phosphat (KH2PO4) | 2,0 g |
| Đỏ phenol |
|
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.10.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 6,8 � 0,2 ở 25 �C, nếu cần.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.10.2 �Dung dịch ure
B.10.2.1 �Th�nh phần
| Ure | 400,0 g |
| Nước, đến thể t�ch cuối c�ng l� | 1 000 ml |
B.10.2.2 �Chuẩn bị
H�a tan ure trong nước. Lọc để khử tr�ng.
B.10.3 �M�i trường ho�n chỉnh
B.10.3.1 �Th�nh phần
| M�i trường cơ bản (B.10.1) | 950 ml |
| Dung dịch ure (B.10.2) | 50 ml |
B.10.3.2 �Chuẩn bị
Cho dung dịch ure một c�ch v� tr�ng v�o m�i trường cơ bản đ� được l�m nguội đến khoảng 44 �C đến 47 �C.
Ph�n phối c�c lượng 10 ml m�i trường ho�n chỉnh v�o c�c ống nghiệm (7.3) v� tr�ng.
Để c�c ống ở tư thế nghi�ng.
B.11� Thạch đỏ congo magie oxalat (CR-MOX)
B.11.1 �M�i trường cơ bản
B.11.1.1 �Th�nh phần
| Thạch đậu tương trypton | 40,0 g |
| Magie clorua ngậm 6 ph�n tử nước (MgCl2. 6H2O) | 4,1 g |
| Natri oxalat (C2Na2O4) | 2,7 g |
| Galactose | 2,0 g |
| Nước | 1 000 ml |
B.11.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường cơ bản kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH của m�i trường ho�n chỉnh l� 7,3 � 0,2 ở 25 �C, nếu cần.
B.11.2 �Dung dịch đỏ congo (25 mg/ml)
B.11.2.1 �Th�nh phần
| Đỏ congo | 2,5 g |
| Nước | 100 ml |
B.11.2.2 �Chuẩn bị
H�a tan đỏ congo trong nước.
CH� TH�CH: Dung dịch đỏ congo c� thể được bảo quản trong chai thủy tinh tối m�u đến 1 năm.
B.11.3 �M�i trường ho�n chỉnh
B.11.3.1 �Th�nh phần
| M�i trường cơ bản (B.11.1) | 1 000ml |
| Dung dịch đỏ congo (B.11.2) | �2 ml |
B.11.3.2 �Chuẩn bị
Cho dung dịch đỏ congo v�o m�i trường cơ bản v� trộn.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.11.3.3 �Chuẩn bị c�c đĩa thạch CR-MOX
R�t khoảng 25 ml m�i trường ho�n chỉnh đ� l�m nguội đến khoảng 47 �C v�o c�c đĩa Petri (7.4) v� tr�ng. Để y�n c�c đĩa.
B.12 �Thạch mật b� v� esculin
B.12.1 �Th�nh phần
| Chất chiết thịt | 3,0 g |
| Sản phẩm thủy ph�n m� động vật bằng enzym | 5,0 g |
| Esculin | 1,0 g |
| Muối mật | 40,0 g |
| Sắt(III) xitrat | 0,5 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.12.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun s�i nhẹ.
Chỉnh pH, sao cho sau khi khử tr�ng l� 6,6 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường với c�c lượng 10 ml v�o c�c ống nghiệm (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
Để nghi�ng ống nghiệm sao cho thu được phần mặt thạch nghi�ng d�i 2,5 cm.
B.13 �Thạch casein-đậu tương để ph�t hiện pyrazinamidase
B.13.1 �Th�nh phần
| Sản phẩm thủy ph�n casein bằng enzym | 15,0 g |
| Sản phẩm thủy ph�n đậu tương bằng enzym | 5,0 g |
| Pyrazinecarboxamid (C5H5N3O) | 1,0 g |
| Natri clorua | 5,0 g |
| Thạch | 12,0 g |
| Đệm tris-maleat (0,2 mol/l, pH 6) | 1 000 ml |
B.13.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun s�i.
Chỉnh pH, sao cho sau khi khử tr�ng l� 7,3 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường với c�c lượng 10 ml v�o c�c b�nh (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) c�i đặt ở nhiệt độ 121 �C.
Sau khi khử tr�ng, để nghi�ng ống nghiệm sao cho thu được phần mặt thạch nghi�ng d�i nhất.
B.14 �Dung dịch amoni sắt(II) sulfat để ph�t hiện pyrazinamidase
B.14.1 �Th�nh phần
| Amoni sắt (II) sulfat | 1,0 g |
| Nước | 100 ml |
B.14.2 �Chuẩn bị
Ngay trước khi sử dụng, h�a tan amoni sắt (II) sulfat trong nước.
B.15 �M�i trường decarboxylase (lyzin hoặc arginin)
B.15.1 �Th�nh phần
| L-lysin hoặc L-arginin | 5,0 g |
| Pepton | 5,0 g |
| Chất chiết nấm men | 3,0 g |
| Glucose | 1,0 g |
| T�a bromocresol | 0,02 g |
| Nước | 1 000 ml |
B.15.2 �Chuẩn bị
H�a tan c�c th�nh phần trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH sao cho sau khi khử tr�ng pH l� 6,8 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường n�y với c�c lượng từ 2 ml đến 5 ml v�o c�c ống nghiệm (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.16 �Thạch phenylalanin (tryptophan) deaminase
B.16.1 �Th�nh phần
| Chất chiết nấm men | 3,0 g |
| L-phenylalanin hoặc | 1,0 g |
| DL-phenylalanin | 2,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 1,0 g |
| Natri clorua | 5,0 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.16.2 �Chuẩn bị
H�a tan c�c th�nh phần tr�n trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH sao cho sau khi khử tr�ng pH l� 7,3 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường n�y với c�c lượng 5 ml v�o c�c ống nghiệm (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
Để y�n ở vị tr� nghi�ng.
B.17 �Sắt (III) clorua, 10 %
B.17.1 �Th�nh phần
| Sắt(III) clorua (FeCl3) | 10,0 g |
| Nước | 90 ml |
B.17.2 �Chuẩn bị
H�a tan sắt(III) clorua trong nước.
B.18 �M�i trường l�n men cacbohydrat (nước pepton với đỏ phenol v� cacbohydrat)
B.18.1 �M�i trường cơ bản
B.18.1.1 �Th�nh phần
| Pepton | 10,0 g |
| Natri clorua | 5,0 g |
| Đỏ phenol | 0,02 g |
| Nước | 1 000 ml |
B.18.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường cơ bản kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng l� 6,8 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường cơ bản n�y v�o c�c b�nh cầu (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 10 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.18.2 �Dung dịch cacbohydrat (melibiose, rhamnose, salicin, sorbitol, sucrose, trehalose hoặc xylose, 100 mg/ml)
B.18.2.1 �Th�nh phần
| Cacbohydrat (melibiose, rhamnose, salicin, sorbitol, sucrose, trehalose hoặc xylose) | 10,0 g |
| Nước | 100 ml |
B.18.2.2 �Chuẩn bị
Chuẩn bị ri�ng rẽ từng dung dịch cacbohydrat bằng c�ch cho từng chất v�o nước cất.
Lọc để khử tr�ng.
B.18.3 �M�i trường ho�n chỉnh
B.18.3.1 �Th�nh phần
| M�i trường cơ bản (B.18.1) | 900 ml |
| Dung dịch cacbohydrat (B.18.2) | 100 ml |
B.18.3.2 �Chuẩn bị
Đối với từng cacbon hydrat, th�m một c�ch v� tr�ng dung dịch cacbohydrat v�o m�i trường cơ bản đ� l�m nguội đến khoảng 45 �C v� trộn đều.
Ph�n phối m�i trường ho�n chỉnh một c�ch v� tr�ng với c�c lượng 10 ml v�o c�c ống nghiệm hoặc chai (7.3) c� dung t�ch th�ch hợp.
B.19 �M�i trường Simmon xitrat
B.19.1 �Th�nh phần
| Natri xitrat | 2,0 g |
| Natri clorua | 5,0 g |
| Dikali hydro phosphat (K2HPO4) | 1,0 g |
| Xanh bromothymol | 0,08 g |
| Amoni dihydro phosphat (NH4H2PO4) | 1,0 g |
| Magie sulfat | 0,2 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.19.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun s�i.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 6,8 � 0,2 ở 25 �C, nếu cần.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.19.3 �Chuẩn bị c�c đĩa Simmon xitrat
R�t khoảng 15 ml m�i trường đ� để nguội đến khoảng 45 �C v�o c�c đĩa Petri v� tr�ng (7.4). Để y�n c�c đĩa.
B.20 �M�i trường thử Tween-esterase
B.20.1 �M�i trường cơ bản
B.20.1.1 �Th�nh phần
| Sản phẩm dịch thủy ph�n peptic của thịt | 10,0 g |
| Natri clorua (NaCl) | 5,0 g |
| Canxi clorua (CaCl2) | 0,1 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.20.1.2 �Chuẩn bị
H�a tan c�c th�nh phần tr�n trong nước bằng c�ch đun s�i, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,4 � 0,2 ở 25 �C, nếu cần.
Khử tr�ng 30 min trong nồi hấp �p lực ở nhiệt độ 121 �C.
B.20.2 �M�i trường ho�n chỉnh
B.20.2.1 �Th�nh phần
| M�i trường cơ bản (D.22.1) | 990 ml |
| Sorbitol mono-oleata | 10 ml |
a Tween 80� l� một v� dụ về sản phẩm th�ch hợp b�n sẵn. Th�ng tin n�y đưa ra tạo thuận tiện cho người sử dụng ti�u chuẩn v� kh�ng ấn định phải sử dụng ch�ng.
B.20.2.2 �Chuẩn bị
Cho sorbitol mono-oleat v�o m�i trường lỏng cơ bản v� trộn đều.
Khử tr�ng 30 min trong nồi hấp �p lực c�i đặt ở nhiệt độ 110 �C.
B.20.3 �Chuẩn bị c�c đĩa tween-esterase
Ph�n phối 15 ml m�i trường ho�n chỉnh đ� l�m nguội đến 45 �C v�o c�c đĩa Petri (7.4) v� tr�ng. Để y�n đĩa.
B.21 �M�i trường trypton/tryptophan
B.21.1 �Th�nh phần
| Sản phẩm thủy ph�n casein (trypton) bằng enzym | 10,0 g |
| Natri clorua | 5,0 g |
| DL-tryptophan | 3,0 g |
| Nước | 1 000 ml |
B.21.2 �Chuẩn bị
H�a tan c�c th�nh phần trong nước bằng c�ch đun s�i, nếu cần
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,5 � 0,2 ở 25 �C.
Ph�n phối m�i trường với c�c lượng 5 ml v�o c�c ống nghiệm hoặc chai (7.3) c� dung t�ch th�ch hợp.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
B.22 �Thuốc thử Kovac
B.22.1 �Th�nh phần
| 4-Dimetylaminobenzaldehyt | 5,0 g |
| Axit clohydric, P = 1,18 g/ml đến 1,19 g/ml | 25 ml |
| 2-Metylbutan-2-ol | 75 ml |
B.22.2 �Chuẩn bị
H�a tan 4-dimetylaminobenzaldehyt trong 2-metylbutan-2-ol để trong nồi c�ch thủy ở 60 �C.
L�m nguội đến nhiệt độ ph�ng rồi đặt b�nh cầu v�o bể nước đ�. Sau đ� th�m cẩn thận axit clohyric, trộn từ từ.
Bảo quản ở 3 �C � 2 �C, trong chai m�u n�u. Kh�ng sử dụng chai c� n�t đậy bằng cao su v� sẽ l�m hỏng thuốc thử.
B.23 �Thử nghiệm hiệu năng về đảm bảo chất lượng của m�i trường nu�i cấy
Xem Bảng B.1. về định nghĩa t�nh chọn lọc v� năng suất, xem TCVN 8128 (ISO 11133). Thể t�ch chất cấy phải giống lượng được sử dụng trong phương ph�p đối với m�i trường đ� v� cần chứa một lượng sinh vật đ�ch hoặc kh�ng phải sinh vật đ�ch như quy định trong 5.4 của TCVN 8128 (ISO 11133).
Bảng B.1 - Ph�p thử hiệu năng để đảm bảo chất lượng của m�i trường nu�i cấy
| M�i trường | Chức năng | Ủ | Chủng kiểm chứng | Số lượng WDCMa | Ti�u ch�d |
| ITC | Năng suất | 44 h � 4 h/ 25 �C � 1 �C | Yersinia enterocolitica Escherichia colic Pseudomonas aeruginosa | 00216b 00012 hoặc 00013 00025 | > 10 khuẩn lạc điển h�nh tr�n CIN (xem 10.5) |
| Yersinia enterocolitica Escherichia colic Pseudomonas aeruginosa | 00160 00012 hoặc 00013 00025 | ||||
| Chọn lọc | Proteus mirabilis | 00023 | Ức chế ho�n to�n (0) hoặc một phần (< 10 khuẩn lạc) tr�n TSA | ||
| PSB | Năng suất | 44 h � 4 h/ 25 �C � 1 �C | Yersinia enterocolitica �Pseudomonas aeruginosa | 00216b 00025 | > 10 khuẩn lạc điển h�nh tr�n CIN (xem 10.5) |
| Yersinia enterocolitica Pseudomonas aeruginosa | 00160 00025 | ||||
| CIN | Năng suất | 24 h � 2 h/ 30 �C 1 �C | Yersinia enterocolitica | 00216b 00160 | C�c khuẩn lạc điển h�nh (2) ph�t triển tốt (xem 10.5). |
| Chọn lọc | Escherichia colic | 00012 hoặc 00013 | Ức chế ho�n to�n hoặc một phần (0 -1), kh�ng c� khuẩn lạc điển h�nh | ||
| Staphylococcus aureus | 00034 | Ức chế ho�n to�n (0) | |||
| Thạch dinh dưỡng | Năng suất | 24 h � 2 h/ 30 �C 1 �C | Yersinia enterocolitica | 00216b 00160 | Ph�t triển tốt (2) |
| a Xem catalog chủng chuẩn tr�n trang www.wfcc.info về th�ng tin bộ sưu tập số lượng chủng cấy v� chi tiết li�n hệ; WDCM: Trung t�m dữ liệu quốc tế về vi sinh vật. b Chủng tối thiểu được sử dụng. c Chủng được tự do lựa chọn; một trong c�c chủng l� chủng tối thiểu phải được sử dụng. d �Xếp loại ph�t triển: 0 kh�ng ph�t triển; 1 ph�t triển yếu (ức chế một phần); 2 ph�t triển tốt [xem TCVN 8128 (ISO 11133)]. CH� TH�CH: H�nh th�i khuẩn lạc của chủng WDCM 00160 (typ huyết thanh sinh học 1B/0:8) kh�ng điển h�nh cho typ huyết thanh sinh học g�y bệnh chủ yếu của Y. enterocolitica (typ huyết thanh sinh học 4/0:3 v� 2/0:9) tr�n thạch CIN. Xem 10.6.2 về v� dụ của chủng kiểm chứng đối với c�c typ huyết thanh sinh học n�y (được sử dụng l� h�nh th�i khuẩn lạc chuẩn trong qu� tr�nh ph�n t�ch mẫu). | |||||
Phụ lục C
(Tham khảo)
C�c nghi�n cứu x�c nhận gi� trị sử dụng v� đặc t�nh hiệu năng của phương ph�p
Một nghi�n cứu li�n ph�ng gồm 13 đến 14 ph�ng thử nghiệm ở 5 quốc gia thực hiện. C�c loại thực phẩm sau đ�y đ� bao gồm trong c�c nghi�n cứu: sữa tươi, thịt xay v� rau diếp. C�c mẫu thực phẩm n�y được thử nghiệm ở hai mức nhiễm kh�c nhau, c�ng với mẫu kiểm so�t �m t�nh. Nghi�n cứu n�y được tổ chức v�o năm 2013 đến năm 2014 do Cơ quan An to�n Thực phẩm Phần Lan Evira được Ủy ban ch�u �u t�i trợ.
C�c mẫu đ� bị l�m nhiễm trong c�c v�ng nghi�n cứu kh�c nhau với chủng Y. enterocolitica typ huyết thanh sinh học 4/0:3 (c�c mẫu sữa tươi nguy�n liệu) v� hai chủng kh�c nhau của Y. enterocolitica typ huyết thanh sinh học 2/0:9 (thịt băm v� rau diếp).
Thực hiện theo quy tr�nh (xem Phụ lục A) v� tất cả c�c chi tiết thực hiện theo ti�u chuẩn n�y. C�c gi� trị của c�c đặc t�nh hiệu năng đối với từng loại mẫu, bắt nguồn từ nghi�n cứu li�n ph�ng thử nghiệm n�y được thể hiện trong c�c Bảng C.1 đến C.3. Dữ liệu thu được bởi một số cộng t�c vi�n đ� bị loại ra khỏi c�c ph�p t�nh to�n chỉ v� c�c l� do kỹ thuật đ� được x�c định r� (sai lệch so với quy tr�nh).
Trong nghi�n cứu li�n ph�ng, việc khẳng định bằng c�ch sử dụng cả hai c�ch thay thế (xem h�nh A.2) đ� được x�c nhận gi� trị sử dụng bằng c�ch so s�nh. Đối với điều n�y, c�c cộng t�c vi�n đ� sử dụng TCVN 11924:2017 (ISO/TS 18867:2015), Phụ lục B, Phương ph�p 1 hoặc Phương ph�p 2 v� thử nghiệm pyrazinamidase (10.6.3.4) song song với c�ch khẳng định bằng sinh h�a (10.6). Kết quả được thống k� trong Bảng C.4. Kết quả ph� hợp thu được từ 410 ph�p thử khẳng định song song.
Bảng C.1 - Kết quả ph�n t�ch số liệu thu được với sữa tươi nguy�n liệu
| Đặc t�nh hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 9 cfu/25 g | Mức nhiễm cao 59 cfu/25 g |
| Số lượng cộng t�c vi�n tham gia | 14 | 14 | 14 |
| Số lượng cộng t�c vi�n giữ lại sau khi đ�nh gi� dữ liệu | 12a | 12a | 12a |
| Số lượng mẫu | 112 | 112 | 112 |
| Số lượng mẫu giữ lại sau khi đ�nh gi� dữ liệu | 96 | 96 | 96 |
| Độ đ�p ứng, % | - | 68 | 96 |
| Độ đặc hiệu, % | 100 | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu | - | 9,4 (7,4 đến 12,0) | |
| a Hai ph�ng thử nghiệm đ� bị loại ra; một ph�ng do sai lệch về quy tr�nh v� một ph�ng kh�c do kh�ng thống nhất trong b�o c�o kết quả. | |||
Bảng C.2 - Kết quả ph�n t�ch dữ liệu thu được với mẫu thịt băm
| Đặc t�nh hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 16 cfu/25 g | Mức nhiễm cao 85 cfu/25 g |
| Số lượng cộng t�c vi�n tham gia | 13 | 13 | 13 |
| Số lượng cộng t�c vi�n giữ lại sau khi đ�nh gi� dữ liệu | 13 | 13 | 13 |
| Số lượng mẫu | 104 | 104 | 104 |
| Số lượng mẫu giữ lại sau khi đ�nh gi� dữ liệu | 104 | 104 | 104 |
| Độ đ�p ứng, % | - | 77 | 97 |
| Độ đặc hiệu, % | 96a | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu |
| 9,9 (7,8 đến 12,5) | |
| a C�c kết quả dương t�nh giả thu được tại ba ph�ng thử nghiệm kh�c nhau (một ph�ng thử nghiệm c� 2 trong 8 mẫu, hai ph�ng thử nghiệm c� 1 trong 8 mẫu). C�c chủng ph�n lập từ c�c mẫu n�y kh�ng thể ph�n biệt được với chủng sử dụng để g�y nhiễm c�c mẫu. Điều n�y cho thấy đ� c� sự nhiễm ch�o của c�c mẫu, từ ph�ng thử nghiệm tổ chức hoặc từ c�c ph�ng thử nghiệm tham gia. | |||
Bảng C.3 - Kết quả ph�n t�ch dữ liệu thu được với mẫu rau diếp
| Đặc t�nh hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 110 cfu/25 g | Mức nhiễm cao 1100 cfu/25 g |
| Số lượng cộng t�c vi�n tham gia | 13 | 13 | 13 |
| Số lượng cộng t�c vi�n giữ lại sau khi đ�nh gi� dữ liệu | 13 | 13 | 13 |
| Số lượng mẫu | 104 | 104 | 104 |
| Số lượng mẫu giữ lại sau khi đ�nh gi� dữ liệu | 103a | 103a | 104 |
| Độ đ�p ứng, % | - | 81 | 98 |
| Độ đặc hiệu, % | 98b | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu | - | 63 (49 đến 81) | |
| a Một mẫu trắng v� một mẫu ở mức thấp đối với một ph�ng thử nghiệm đ� bị loại ra khỏi ph�n t�ch do thiếu c�c ph�p thử khẳng định. b C�c kết quả dương t�nh giả thu được tại hai ph�ng thử nghiệm kh�c nhau (1 trong 8 mẫu). C�c chủng ph�n lập từ c�c mẫu n�y kh�ng thể ph�n biệt được với chủng sử dụng để g�y nhiễm c�c mẫu. Điều n�y cho thấy đ� c� sự nhiễm ch�o của c�c mẫu, từ ph�ng thử nghiệm tổ chức hoặc từ c�c ph�ng thử nghiệm tham gia. | |||
Bảng C.4 - Kết quả khẳng định Y. enterocolitica g�y bệnh sử dụng c�c phương ph�p thay thếa
| Đặc t�nh hiệu năng | Số lượng ph�ng thử nghiệm | Số lượng mẫu với ph�p khẳng định song song3 | Số lượng phản ứng khẳng định song song | Số lượng kết quả kh�ng thống nhất |
| Kết quả khẳng định/sữa tươi nguy�n liệu | 7 | 91 | 119 | 0 |
| Kết quả khẳng định/thịt băm | 8 | 122 | 130 | 0 |
| Kết quả khẳng định/rau diếp | 8 | 106 | 161 | 0 |
| Kết quả khẳng định/tất cả nền mẫu |
| 319 | 410 | 0 |
| a Xem H�nh A.2 về diễn giải c�c phương ph�p khẳng định thay thế. Để khẳng định c�c khuẩn lạc, c�c cộng t�c vi�n đ� sử dụng TCVN 11924:2017 (ISO/TS 18867:2015), Phụ lục B. Phương ph�p 1 hoặc phương ph�p 2 v� thử nghiệm pyrazinamidase (10.6.3.4) song song với khẳng định sinh h�a (10.6). | ||||
Phụ lục D
(Tham khảo)
D.1 �Giới thiệu
Quy tr�nh tăng sinh lạnh n�u trong Phụ lục n�y c� thể được sử dụng để bổ sung cho quy tr�nh chung trong c�c điều tra, chẳng hạn như trong c�c vụ ngộ độc thực phẩm. C� thể sử dụng canh thang CEB (D.3.1) hoặc PSB (B.2).
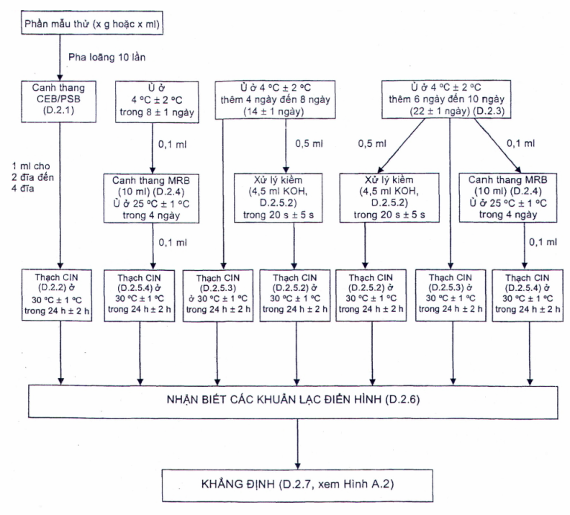
H�nh D.1 - Sơ đồ quy tr�nh tăng sinh lạnh
CH� TH�CH: C� thể được sử dụng PCR Real-time nhắm v�o gen ail đ�ch để s�ng lọc c�c mẫu dương t�nh trong canh thang PSB sau khi ủ 24 h ở 25 ⁰C. Xem TCVN 11924 (ISO/TS 18867) để biết chi tiết về quy tr�nh.
D.2 �Ph�t hiện Y. enterocolitica g�y bệnh bằng tăng sinh lạnh
D.2.1 �Phần mẫu thử v� huyền ph� ban đầu
Xem phần li�n quan của TCVN 6507 (ISO 6887) (tất cả c�c phần) hoặc bất kỳ ti�u chuẩn cụ thể kh�c ph� hợp với sản phẩm c� li�n quan.
Để chuẩn bị huyền ph� ban đầu, trong trường hợp chung, sử dụng như dịch pha lo�ng m�i trường tiền tăng sinh trong D.3.1 (CEB) hoặc B.2 (PSB).
Nh�n chung, một lượng phần mẫu thử (khối lượng hoặc thể t�ch) được th�m v�o một lượng CEB hoặc PSB (khối lượng hoặc thể t�ch) để thu được độ pha lo�ng mười lần. Đối với điều n�y, một phần mẫu thử 25 g được trộn với 225 ml CEB hoặc PSB.
Đồng h�a huyền ph�, tốt nhất l� sử dụng m�y trộn nhu động (7.8) trong 1 min.
D.2.2 �Nu�i cấy trực tiếp tr�n thạch chọn lọc
Xem 10.2.
D.2.3 �Tăng sinh
Ủ huyền ph� ban đầu của CEB hoặc PSB (D.2.1) ở 4 �C trong 22 ng�y � 1 ng�y.
D.2.4 �Tăng sinh lần thứ hai
Sau 8 ng�y � 1 ng�y v� 22 ng�y � 1 ng�y ủ CEB hoặc PSB (D.2.1), chuyển 0,1 ml dịch tăng sinh sang 10 ml canh thang MRB (D.3.2) v� ủ ở 25 �C trong 4 ng�y.
D.2.5 �Nu�i cấy tr�n đĩa thạch v� ủ đĩa
D.2.5.1 �Y�u cầu chung
Sau khi ủ m�i trường tăng sinh (D.2.3 v� D.2.4), tiến h�nh như sau:
CH� TH�CH: C� thể sử dụng c�c đĩa bổ sung như m�i trường thạch sinh m�u để ph�t hiện Y. enterocolitica g�y bệnh [9,13,18].
D.2.5.2 �Nu�i cấy từ CEB hoặc PSB c� xử l� KOH tr�n thạch CIN
Sau 14 ng�y � 1 ng�y v� 22 ng�y � 1 ng�y ủ ở 4 �C, sử dụng pipet v� tr�ng (7.5) chuyển 0,5 ml dịch tăng sinh CEB hoặc PSB (D.2.3) v�o 4,5 ml dung dịch KOH (B.5) (chuẩn bị ngay trước khi sử dụng) v� trộn đều [7]. Sau khi để 20 s � 5 s dịch tăng sinh CEB hoặc PSB v�o dung dịch KOH, ria cấy sử dụng v�ng cấy (7.6) l�n mặt thạch đĩa CIN (B.6) sao cho thu được c�c khuẩn lạc ri�ng rẽ.
CH� TH�CH 1: C�c kết quả tốt nhất thu được bằng c�ch sử dụng dung dịch KOH đ� chuẩn bị một ng�y trước đ�.
CH� TH�CH 2: Trong qu� tr�nh xử l� kiềm, dịch tăng sinh được l�m lo�ng 10 lần. Ngo�i ra, việc xử l� n�y c� thể l�m giảm số lượng Y. enterocolitica g�y bệnh trong dịch cấy. Do đ�, trong một số trường hợp cấy th�m một đĩa CIN với 0,1 ml dịch cấy.
D.2.5.3 �Nu�i cấy từ CEB hoặc PSB kh�ng xử l� KOH
Sau 14 ng�y � 1 ng�y v� 22 ng�y � 1 ng�y ủ ở 4 �C, d�ng v�ng cấy v� tr�ng (7.6) cấy một ăng dịch tăng sinh CEB hoặc PSB (D.2.3) l�n mặt thạch đĩa CIN (B.6) sao cho thu được c�c khuẩn lạc ri�ng rẽ.
D.2.5.4 �Nu�i cấy đĩa từ lần tăng sinh thứ hai (MRB)
Sau khi ủ 4 ng�y trong lần tăng sinh thứ hai MRB (D.2.4), sử dụng pipet (7.5) v� tr�ng lấy 0,1 ml dịch cấy MRB nhỏ l�n bề mặt đĩa thạch (CIN) (B.6) v� d�ng tăm b�ng hoặc bộ d�n mẫu (7.6) d�n đều dịch cấy sao cho thu được c�c khuẩn lạc ri�ng rẽ.
D.2.5.5 �Ủ c�c đĩa
Lật �p c�c đĩa (D.2.5.2 đến D.2.5.4) v� đặt v�o tủ ấm (7.2) ở 30 �C (7.2) trong 24 h � 2 h.
D.2.6 �Nhận dạng c�c khuẩn lạc điển h�nh
Xem 10.5.
D.2.7 �Khẳng định Y. enterocolitica g�y bệnh
Xem 10.6 v� H�nh A.2.
D.2.8 �X�c định typ sinh học của Y. enterocolitica
Xem 10.7.
D.3 �M�i trường nu�i cấy
D.3.1 �Canh thang tăng sinh lạnh (CEB)
D.3.1.1 �Th�nh phần
| Dinatri hydro phosphat (Na2HPO4) | 7,6 g |
| Kali dihydro phosphat (KH2PO4) | 1,0 g |
| Natri clorua | 8,5 g |
| Sorbitol | 20,0 g |
| Muối mật (số 3) | 1,5 g |
| Nước | 1 000 ml |
D.3.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH l� 7,6 � 0,2 ở 25 �C, nếu cần.
Ph�n phối m�i trường n�y v�o c�c vật chứa c� dung t�ch th�ch hợp để thu được c�c phần mẫu thử th�ch hợp (xem D.3.1).
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
D.3.2 �M�i trường canh thang rappaport cải biến (MRB) bằng magie clorua
D.3.2.1 �M�i trường cơ bản
D.3.2.1.1 �Th�nh phần
| Sản phẩm thủy ph�n casein bằng enzym | 10,0 g |
| Chất chiết nấm men | 1,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 2,0 g |
| Xanh malachit | 0,013 g |
| Nước | 800 ml |
D.3.2.1.2 �Chuẩn bị
H�a tan c�c th�nh phần hoặc m�i trường ho�n chỉnh kh� trong nước bằng c�ch đun n�ng, nếu cần.
Chỉnh pH, sao cho sau khi khử tr�ng pH của m�i trường ho�n chỉnh l� 5,8 � 0,1 ở 25 �C, nếu cần.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
D.3.2.2 �Dung dịch magie clorua (0,4 g/ml)
D.3.2.2.1 �Th�nh phần
| Magie clorua ngậm s�u ph�n tử nước (MgCl2.6 H2O) | 80,0 g |
| Nước | 200 ml |
D.3.2.2.2 �Chuẩn bị
H�a tan magie clorua trong nước.
Khử tr�ng 15 min trong nồi hấp �p lực (7.1) ở nhiệt độ 121 �C.
D.3.2.3 �M�i trường ho�n chỉnh
D.3.2.3.1 �Th�nh phần
| M�i trường cơ bản (D.3.2.1) | 800 ml |
| Dung dịch magie clorua (D.3.2.2) | 200 ml |
D.3.2.3.2 �Chuẩn bị
Cho dung dịch magie clorua một c�ch v� tr�ng v�o m�i trường cơ bản v� trộn đều.
Ph�n phối 10 ml m�i trường n�y một c�ch v� tr�ng v�o c�c ống nghiệm (7.3).
C�c dung dịch phải được l�m nguội đến nhiệt độ ph�ng trước khi trộn để tr�nh tạo th�nh kết tủa.
D.3.3 �Thử nghiệm hiệu năng đảm bảo chất lượng của m�i trường tăng sinh lạnh
Về định nghĩa tinh chọn lọc v� năng suất, xem TCVN 8128 (ISO 11133). Thể t�ch dịch cấy phải giống lượng được sử dụng trong phương ph�p đối với m�i trường đ� v� cần chứa một lượng sinh vật đ�ch v� kh�ng phải đ�ch như quy định trong 5.4 của TCVN 8128 (ISO 11133).
Bảng D.1 - Thử nghiệm hiệu năng đảm bảo chất lượng của m�i trường tăng sinh lạnh
| M�i trường | Chức năng | Ủ | Chủng kiểm chứng | Số lượng WDCMa | Ti�u ch�d |
| MRB | Năng suất | 44 h � 4 h / 25 �C � 1 �C | Yersinia enterocolitica Escherichia coli c Pseudomonas aeruginosa | 00160b 00012 hoặc 00013 00025 | > 10 khuẩn lạc đặc trưng tr�n CIN (xem 10.5) |
| Chọn lọc | Pseudomonas aeruginosa Proteus mirabilis | 00025 00023 | Ức chế ho�n to�n (0) hoặc một phần (< 10 khuẩn lạc) tr�n TSA | ||
| CEB | Năng suất | 44 h � 4 h/ 25 �C � 1 �C | Yersinia enterocolitica Pseudomonas aeruginosa | 00160b 00025 | > 10 khuẩn lạc điển h�nh tr�n CIN (xem 10.5) |
| a Xem catalog về chủng chuẩn tr�n trang www.wfcc.info về th�ng tin bộ sưu tập chủng cấy v� chi tiết li�n hệ: WDCM: Trung t�m dữ liệu quốc tế về vi sinh vật. b Chủng tối thiểu được sử dụng. c Chủng được tự do lựa chọn; một trong c�c chủng l� chủng tối thiểu phải được sử dụng. d Xếp loại ph�t triển: 0 kh�ng ph�t triển; 1 ph�t triển yếu (ức chế một phần); 2 ph�t triển tốt [xem TCVN 8128 (ISO 11133)]. CH� TH�CH: H�nh th�i khuẩn lạc của chủng WDCM 00160 (typ huyết thanh sinh học 1B/0:8) kh�ng điển h�nh cho typ huyết thanh sinh học g�y bệnh chủ yếu của Y. enterocolitica (typ huyết thanh sinh học 4/0:3 v� 2/0:9) tr�n thạch CIN. Xem 10.6.2 về v� dụ của chủng kiểm chứng đối với c�c typ huyết thanh sinh học n�y (được sử dụng l� h�nh th�i khuẩn lạc chuẩn trong qu� tr�nh ph�n t�ch mẫu). | |||||
Thư mục t�i liệu tham khảo
[1] TCVN 10782 (ISO 13307) Vi sinh vật trong thực phẩm v� thức ăn chăn nu�i - Giai đoạn sản xuất ban đầu - Kỹ thuật lấy mẫu
[2] TCVN 11922 (ISO 17468) Vi sinh vật trong chuỗi thực phẩm - Y�u cầu v� hướng dẫn kỹ thuật để x�y dựng hoặc so�t x�t phương ph�p chuẩn
[3] TCVN 7925 (ISO 17604) Vi sinh vật trong thực phẩm v� thức ăn chăn nu�i - Phương ph�p lấy mẫu th�n thịt tươi để ph�n t�ch vi sinh vật
[4] TCVN 11923 (ISO/TS 17728) Vi sinh vật trong chuỗi thực phẩm - Kỹ thuật lấy mẫu để ph�n t�ch vi sinh vật trong thực phẩm v� thức ăn chăn nu�i
[5] TCVN 8129 (ISO 18593) Vi sinh vật trong thực phẩm v� thức ăn chăn nu�i - Phương ph�p lấy mẫu bề mặt sử dụng đĩa tiếp x�c v� lau bề mặt
[6] TCVN 11924 (ISO/TS 18867) Vi sinh vật trong chuỗi thực phẩm - Phản ứng chuỗi polymerase (PCR) để ph�t hiện vi sinh vật g�y bệnh từ thực phẩm - Ph�t hiện Yersinia enterocolitica v� Yersinia pseudotuberculosis g�y bệnh
[7] AULISIO C.C.G., MEHLMAN I.J. and SANDERS A.C. Alkali method for rapid recovery of Yersinia enterocolitica and Yersinia pseudotuberculosis from foods. Appl. Environ. Microbiol. 1980, 39 pp. 135-140
[8] BOTTONE E.J. Yersinia enterocolitica: Overview and epidemiologic correlates. Microbes Infect. 1999, 1 (4) pp. 323-333
[9] DENIS M., HOUARD E., LABB� A., FONDREVEZ M. and SALVAT G.A. A Selective Chromogenic Plate, YECA, for the Detection of Pathogenic Yersinia enterocolitica: Specificity, Sensitivity, and Capacity to Detect Pathogenic Y. enterocolitica from Pig Tonsils. Journal of Pathogens, vol. 2011, Article ID 296275, 8 pages, 2011. doi: 10.4061/2011/296275
[10] FARMER J.J. Ill, CARTER G.P., MILLER V.L., FALKOW S. and WACHSMUTH I.K. Pyrazinamidase, CR-MOX Agar, Salicin Fermentation - Esculin Hydrolysis, and D-Xylose fermentation for identifying pathogenic serotypes of Yersinia enterocolitica. J. Clin. Microbiol. 1992, 30 pp. 2589-2594
[11] FOOD AND DRUG ADMINISTRATION. Protocol in FDA. Yersinia enterocolitica and Yersinia pseudotuberculosis. Chapter 8 In: Bacteriological Analytical Manual, 8th edn., Washington, DC, 1998, online version updated in 2007: www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm072633.htm
[12] HALLANVUO S., PELTOLA J., HEISKANEN T. and SIITONEN A. Simplified phenotypic scheme evaluated by 16S rRNA sequencing for differentiation between Yersinia enterocolitica and Y. enterocolitica -like species. J. Clin. Microbiol. 2006, 44 pp. 1077-1080
[13] RENAUD N., LECCI L, COURCOL R.J., SIMONET M. and GAILLOT O. CHROMagar Yersinia, a new chromogenic agar for screening of potentially pathogenic Yersinia enterocolitica isolates in stools. J. Clin. Microbiol. 2013, 51 pp. 1184-1187
[14] RILEY G. and TOMA S. Detection of pathogenic Yersinia enterocolitica by using Congo red-magnesium oxalate agar medium. J. Clin. Microbiol. 1989, 27 pp. 213-214
[15] SCHIEMANN D A. Synthesis of selective agar medium for Yersinia enterocolitica. Can. J. Microbiol. 1979, 25 pp. 1298-1304
[16] TENNANT S.H., GRANT T.H. and ROBINS-BROWNE R.M. Pathogenicity of Yersinia enterocolitica typ huyết thanh 1A. FEMS Immun. Medical Microbiol. 2003, 38 pp. 127-137
[17] WAUTERS G., GOOSSENS V., JANSSENS M. and VANDEPITTE J. New enrichment method for isolation of pathogenic Yersinia enterocolitica serogroup O:3 from pork. Appl. Environ. Microbiol. 1988, 54 pp. 851-854
[18] WEAGANT S.D. A new chromogenic agar medium for detection of potentially virulent Yersinia enterocolitica. J. Microbiol. Methods. 2008, 72 pp. 185-190
2) Vaselin� l� v� dụ về sản phẩm th�ch hợp c� b�n sẵn. Th�ng tin đưa ra tạo thuận tiện cho người sử dụng ti�u chuẩn n�y v� kh�ng ấn định phải sử dụng sản phẩm n�y.

